Acide, Base et pH
Définitions :
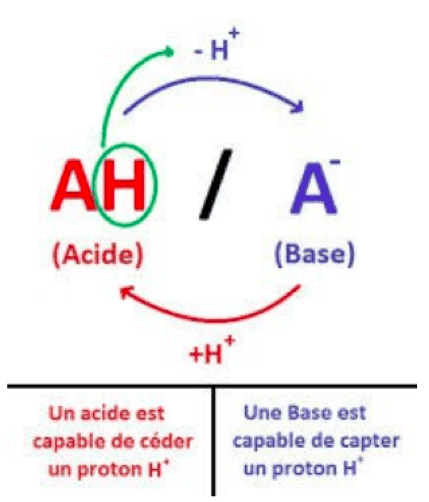
- Un acide est une espèce capable de céder un proton en donnant une autre entité ou espèce chimique : la base conjuguée.
- Une base est une espèce capable d'accepter un proton en donnant une autre entité ou espèce chimique : l'acide conjugué.
Une solution acide, contiendra donc beaucoup d’ions $\rm H_3O^+$.
- Exemple d’acide : acide éthanoïque $\rm CH_3CH_2OH_{(aq)}$, acide chlorhydrique $\rm H_3O^+(aq)+Cl^−(aq)$
- Exemple de base : ammoniac $\rm NH_{3(aq)}NH_{3(aq)}$, hydroxyde de sodium Na+(aq)+HO−(aq)
Une solution basique contiendra donc beaucoup d’ions $\rm HO^-$.
Le pH peut :
- Se mesurer expérimentalement grâce à du papier pH, un pH mètre ou par dosage.
- Se calculer grâce à la formule : $\rm pH=-log[H_3 O^+]$, avec $\rm [H_3O^+]$ la concentration molaire en ions $\rm H_3O^+$ en mol/L
Pour rappel, un pH acide est inférieur à 7, un pH neutre égal à 7 et un pH basique supérieur à 7.
Lors de l’ajout d’eau distillée à une solution :
Cas 1 : Si la solution initiale a un pH inférieur à celui de l’eau distillée utilisée, alors le pH mesuré après dilution est compris entre ceux de la solution initiale et de l’eau distillée.
Cas 2 : Si la solution initiale a un pH supérieur à celui de l’eau distillée utilisée, alors le pH mesuré après dilution est compris entre ceux de l’eau distillée et de la solution initiale.