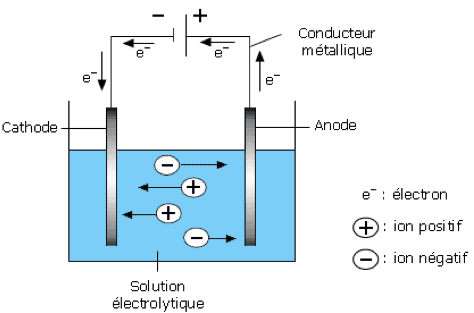
Concentration massique et molaire, dilution, dissolution
La concentration en masse de soluté en $\rm g.L^{−1}$ dans une solution est $\rm C_m=m_{soluté~dissous}V_{solution}$.
La solution est saturée : le soluté ne se dissout plus dans le solvant quand la concentration en masse de soluté est maximale.
On peut préparer une solution par :
- Dissolution : si le soluté est solide, on calcule la masse de soluté avec
$\rm m_{soluté}=C_m \times V_{solution}$ en utilisant une fiole jaugée de volume égal au volume de solution à préparer.
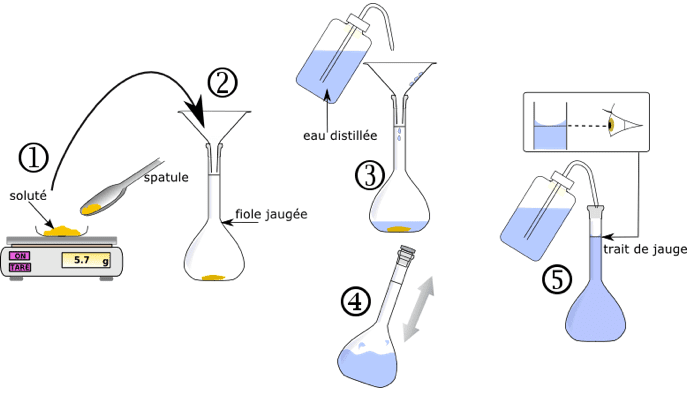
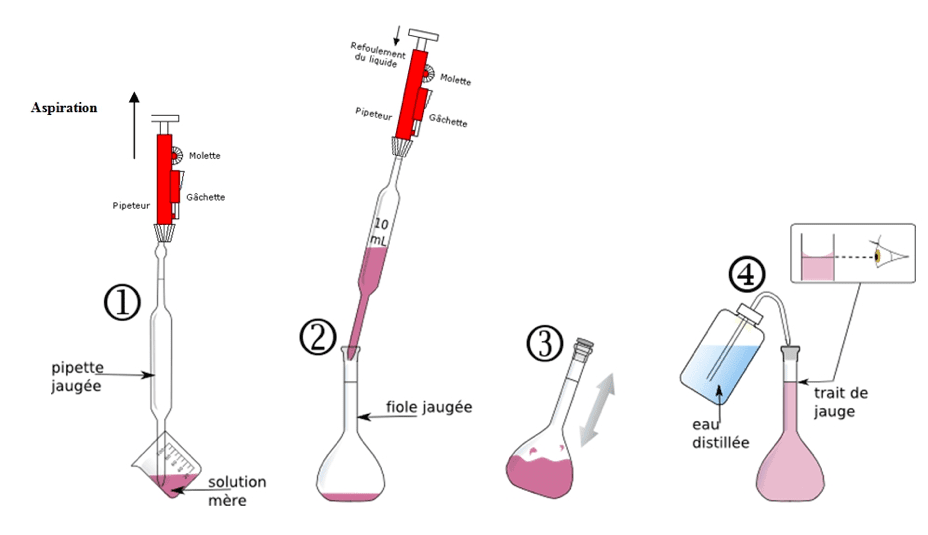
- Dilution : diluer une solution mère de concentration en masse $\rm C_{m0}$ connue, consiste à y ajouter du solvant afin de préparer un volume $V_1$ de solution fille de concentration en masse $\rm C_{m1}$. On cherche le volume $\rm V_0$ à prélever avec une pipette jaugée et à introduire dans la fiole jaugée de volume $\rm V_1$. Au cours d’une dilution, la masse de soluté dissous se conserve donc $\rm m_0=m_1$ donc $\rm C_{m0} \times V_0= C_{m1} \times V_1$.
Un dosage par étalonnage consiste à préparer des solutions filles à partir d’une solution mère étalon et ainsi, de comparer la couleur (échelle de teintes) de la solution avec celles des solutions filles préparées pour avoir un encadrement de la concentration massique de la solution.
La quantité de matière $\rm n$ (en mol) est utilisée pour dénombrer les entités (atomes, molécules, ions). On écrit : $\rm n=N/N_A$ avec $\rm N$ nombre d’entités et $\rm N_A$ constante d'Avogadro avec $\rm N_A=6,02⋅10^{23} ~mol^{−1}$.
La masse molaire atomique $\rm M$ en $\rm g.mol^{−1}$ d’un élément est la masse d’une mole d’atomes de cet élément. On écrit $\rm M=N_A \times m$ avec $\rm m$ masse de l’entité en g. On trouve les valeurs des masses molaires atomiques dans le tableau périodique. La masse molaire moléculaire M en $\rm g.mol^{−1}$ d’un élément est la masse d’une mole de molécules : elle est égale à la somme des masses molaires atomiques de tous les atomes qui constituent la molécule.
Le volume molaire $\rm V_m$ d’une espèce à l’état gazeux est le volume occupé par une mole de gaz à températures fixées. À 20°C et 1013 hPa, le volume occupé par une mole de gaz est $\rm V_m=24,0~ L.mol^{−1}$.