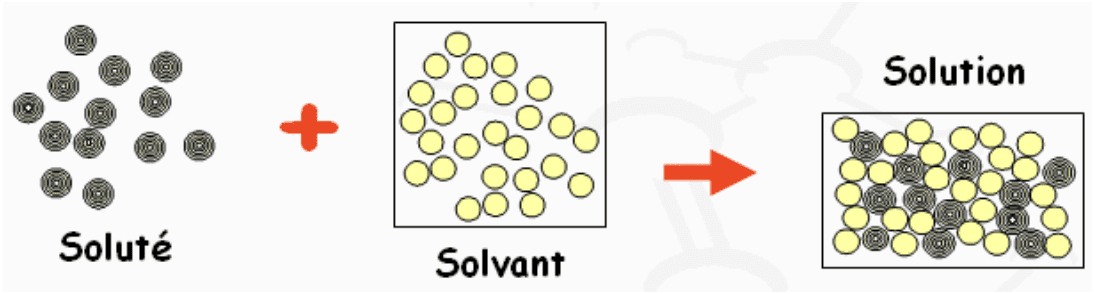
Une solution est un mélange homogène obtenu par dissolution d’un ou plusieurs solutés (sous formes moléculaire ou ionique) dans un solvant (espèce chimique majoritaire).
L’eau, qui contient des minéraux (que l’on peut lire derrière une bouteille d’eau), est donc une solution et non un corps pur.
Calcul d’une masse molaire moléculaire
La masse molaire moléculaire M en g.mol−1 d’un élément est la masse d’une mole de molécules : elle est égale à la somme des masses molaires atomiques de tous les atomes qui constituent la molécule.
Ex : le glucose : C6H12O6
M(C) = 12 g/mol
M(H) = 1 g/mol
M(O) = 16 g/mol
D’où M(C6H12O6) = 6 x 12 + 12 x 1 + 6 x 16 = 180 g/mol
Réalisation d’une solution de concentration en quantité de matière donnée par dilution ou dissolution
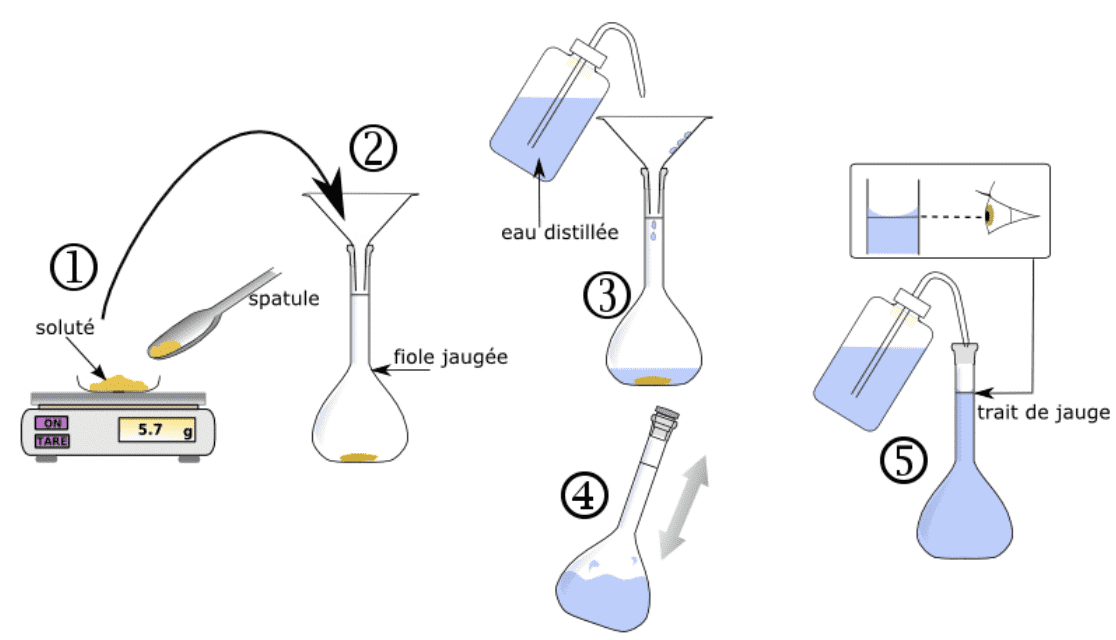
- Dissolution : si le soluté est solide, on calcule la quantité de matière de soluté avec nsoluté=C × Vsolution en utilisant une fiole jaugée de volume égal au volume de solution à préparer.
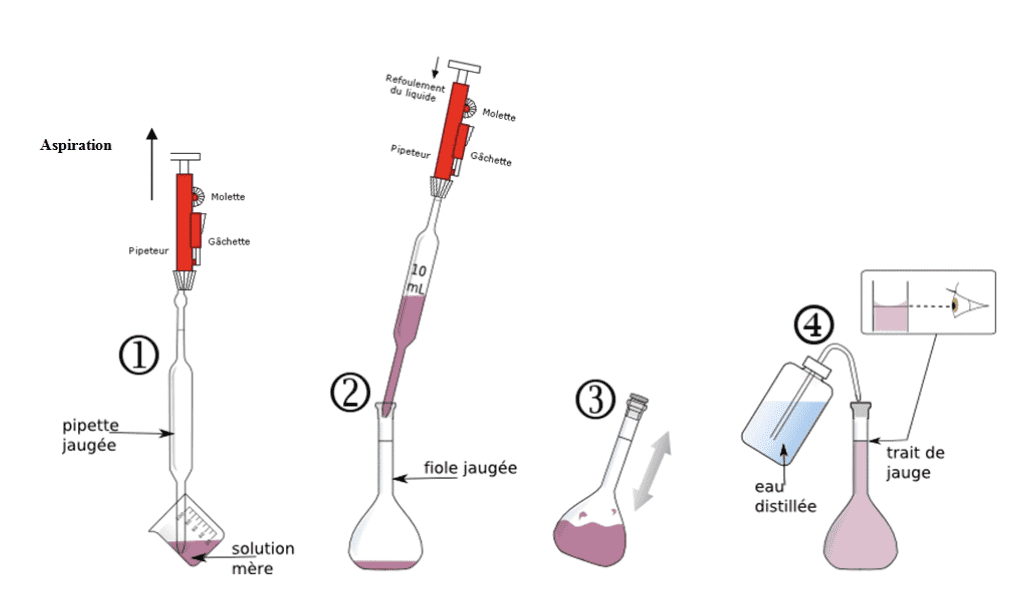
- Dilution : diluer une solution mère de concentration molaire C0 connue, consiste à y ajouter du solvant afin de préparer un volume V1 de solution fille de concentration en masse C1. On cherche le volume V0 à prélever avec une pipette jaugée et à introduire dans la fiole jaugée de volume V1. Au cours d’une dilution, la quantité de matière de soluté dissous se conserve donc n0=n1 et C0×V0=C1×V1.