Dosage par titrage
Un dosage permet de déterminer la quantité de matière ou la concentration d’une espèce chimique dissoute dans une solution. Lors d’un dosage par titrage, la réaction chimique est totale et rapide.
Lors d’un titrage, un réactif titré A dont on cherche la concentration CA réagit avec un réactif titrant B de concentration connue.
Dosage pH-métrique
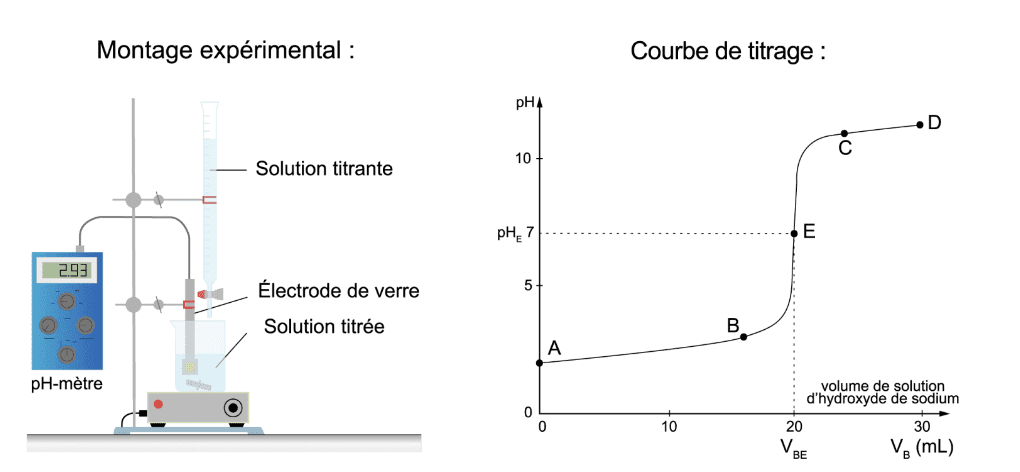
On peut effectuer un titrage pH-métrique (à l’aide d’un pH-mètre) si l’on cherche à doser un acide ou une base.
Méthode :
- On place un volume précis (pipette jaugée) de l’espèce acide ou basique à doser dans un bécher.
- On plonge la sonde d’un pH-mètre dans le bécher en ajoutant de l’eau distillée (à l’éprouvette graduée), si besoin de manière à ce que la sonde trempe suffisamment dans la solution.
- On verse alors la solution titrante mL par mL (avec une burette graduée) en relevant, lors de chaque ajout, la valeur du pH mesurée.
- À la fin du dosage, on trace la courbe pH=f(V).
- À l’aide de la méthode des tangentes ou de la dérivée, on détermine le volume Véq de solution titrante ajoutée lors de l’équivalence du dosage.
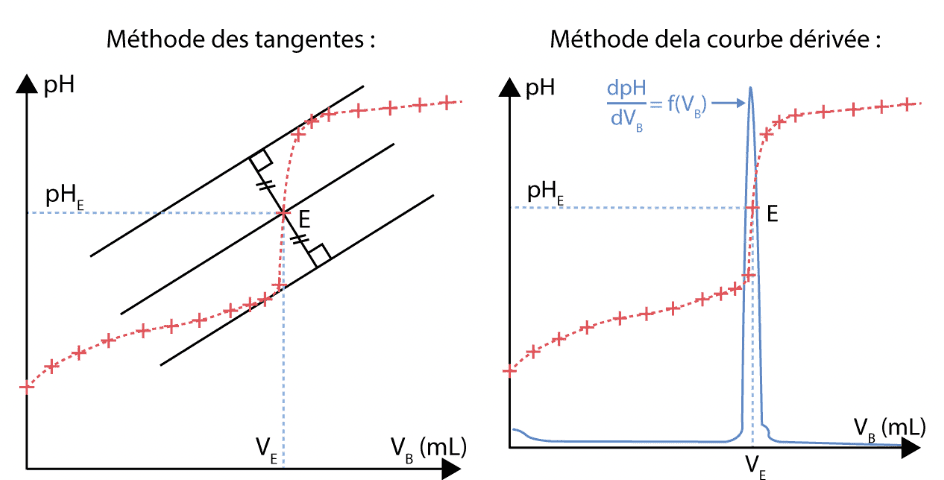
- Tracer d’abord deux tangentes à la courbe pH=f(VB), parallèles entre elles et situées avant et après le saut du pH.
- Tracer ensuite la parallèle à ces deux tangentes, équidistante de celles-ci. Son intersection avec la courbe pH=f(VB) détermine le point équivalent E de coordonnées (VBE ; pHE).
À l’équivalence, le réactif titré (acide ascorbique) et le réactif titrant HO− ont été introduits dans les proportions stœchiométriques de l’équation de titrage.
n(C6H8O6)=n(HO−)
CAVA=CBVBE
$C_A =\displaystyle \frac{C_B \cdot V_{B E}}{V_A}$
Au cours du titrage colorimétrique, on verse le réactif titrant jusqu’à ce que le réactif titré ait totalement réagi : on a alors atteint l’équivalence. Un changement de couleur du milieu réactionnel permet de repérer l’équivalence. À l’équivalence, les deux réactifs ont été totalement consommés : on a réalisé un mélange stœchiométrique.
Soit la réaction de support du titrage,
aA+bB+$\rightarrow cC+ dDaA+bB+\rightarrow cC+dD$
à l’équivalence, on a la relation
$\displaystyle \frac{n_0(A)}{a}=\frac{n_E(B)}{b}$
Soit $\displaystyle \frac{C(A) \times V(A)}{a}=\frac{C(B) \times V(B)}{b}$
On peut ainsi déterminer la concentration du réactif titré C(A).
Calcul d’un titre hydrotimétrique, l’expression littérale étant fournie
Le titre hydrotimétrique, plus connu sous le nom de TH, est l'indicateur de minéralisation de l'eau. Cela représente la somme des ions calcium magnésium contenus dans l'eau.
C'est l'un des indicateurs de la qualité de l'eau, l'autre étant le TAC (Titre Alcalimétrique Complet). Le TH indique la dureté de l'eau et s'exprime en ºf (degrés français).


