La classification périodique présente l’ensemble des éléments chimiques connus. Tout l’intérêt de ce tableau est d’organiser les éléments de telle sorte que leurs propriétés physico-chimiques puissent être largement prédites par leur position dans la table. Ainsi, pour pouvoir tirer profit de la classification, il faut comprendre son organisation.
Comment est organisée la classification périodique ?
Les éléments chimiques sont classés de gauche à droite par numéro atomique, Z, croissant. Pour rappel, le numéro atomique est le nombre de protons dans le noyau de l’élément.
Chaque ligne (ou période) correspond à une couche électronique identifiée par son nombre quantique principal, n. Chaque ligne aboutit à un gaz rare pour lequel la couche de valence est saturée. Lorsqu’on passe à la ligne suivante on commence alors à remplir une nouvelle sous couche ns.
Les éléments d’une même colonne présente des configurations de valence similaires. Ainsi chaque colonne correspond à une famille chimique (exemples : colonne 1 = les alcalins, colonne 2 = les alcalino-terreux, colonne 17 = les halogènes, colonne 18 = les gaz nobles).
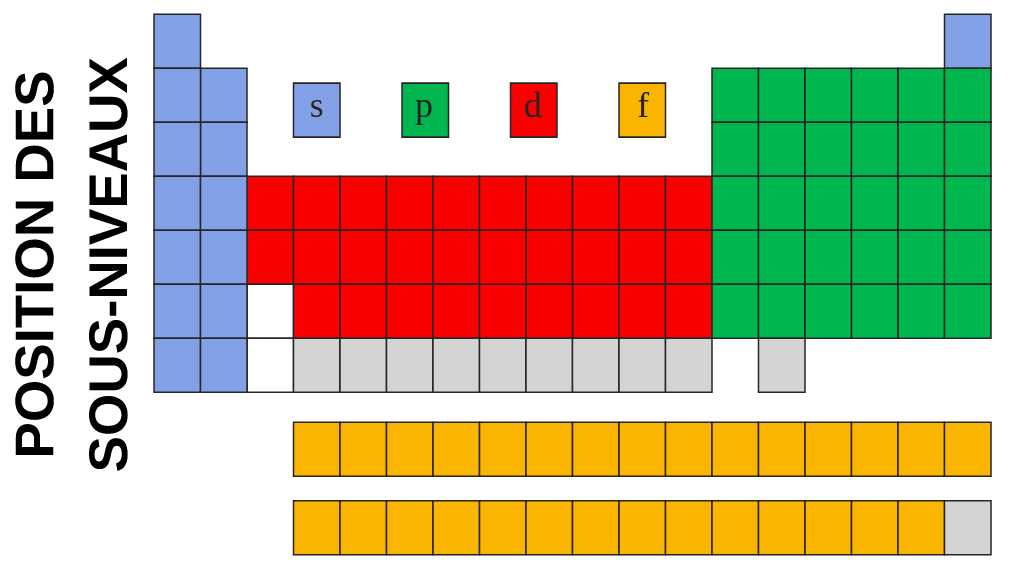
La classification laisse apparaître 4 blocs : s, p, d et f en référence à la dernière sous couche de remplissage.
Comment évolue le rayon atomique dans le tableau ?
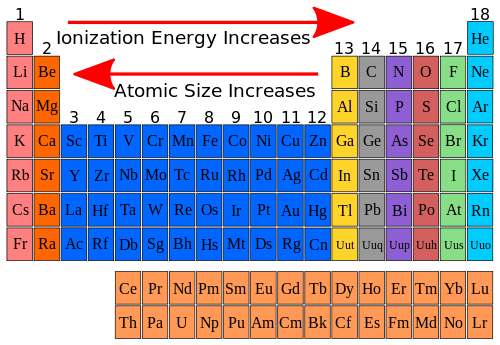
Le rayon atomique augmente de haut en bas du tableau car à chaque période s’ajoute une couche électronique.
De la gauche vers la droite, le rayon atomique diminue malgré le fait qu’il y ait de plus en plus d’électrons. Cette décroissance s’explique par le fait que plus il y a d’électrons, plus l’attraction du noyau sur les électrons est forte et donc plus le rayon atomique est petit.
Comment évolue l’énergie d’ionisation dans le tableau ?
L’énergie d’ionisation (énergie minimum nécessaire pour retirer un électron à un atome) augmente du bas vers le haut et de la gaucher vers la droite du tableau car les électrons sont d’autant plus liés au noyau qu’ils sont dans des sous-couches intérieures.
Remarque : même évolution pour l’électronégativité.
Comment évoluent les caractères oxydant et réducteur ?
À gauche du tableau, les éléments ont une faible électronégativité et perdent donc facilement un ou des électrons par oxydation. Ce sont donc de bons réducteurs. De plus, l’électronégativité diminuant de haut en bas dans une colonne, plus on descend, plus le réducteur est fort.
À l’inverse, les oxydants se trouvent à droite de la classification et ils sont d’autant plus forts qu’ils sont en haut.




