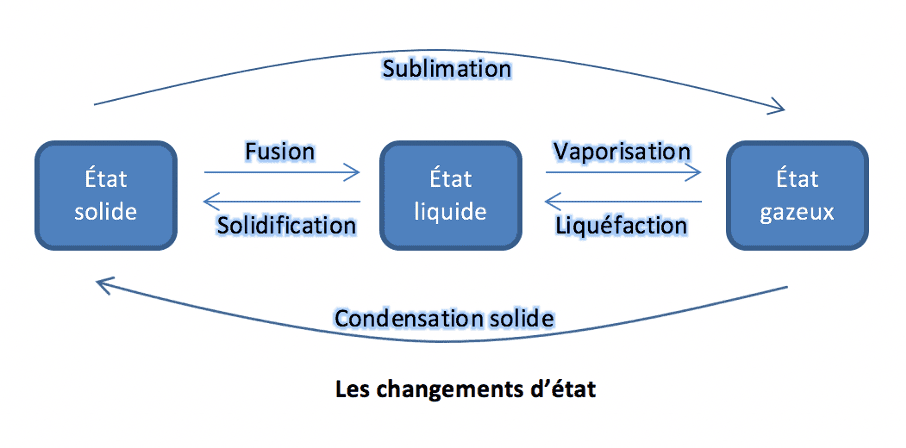
La température est une grandeur physique qui caractérise l’agitation des particules qui composent la matière. Un thermomètre permet de mesurer cette grandeur.
En France, l’échelle de température adoptée est l’échelle Celsius $\rm (°C)$. Sur cette échelle, $\rm 0°C$ correspond à la température de solidification de l’eau et $\rm 100°C$ correspond à celle d’ébullition de l’eau (au niveau de la mer, sous la pression atmosphérique de $\rm 1~013~hPa$).
Dans le système international, nous utilisons l’échelle Kelvin $\rm (K)$, qui ne comporte que des valeurs positives. Sur cette échelle :
- $\rm 0~ K$ correspond au zéro absolu, température où les particules sont totalement figées.
- $\rm 273,15~ K$ correspond à la température de solidification de l’eau
- $\rm 373,15~ K$ correspond à celle d’ébullition de l’eau.
Il existe une relation mathématique entre l’échelle Celsius et l’échelle Kelvin, où $\rm T~ (K)$ représente la température en Kelvin et $\rm T~ (°C)$ représente celle en degré Celsius : $\rm T~ (K) = T~ (°C)+273,15$.