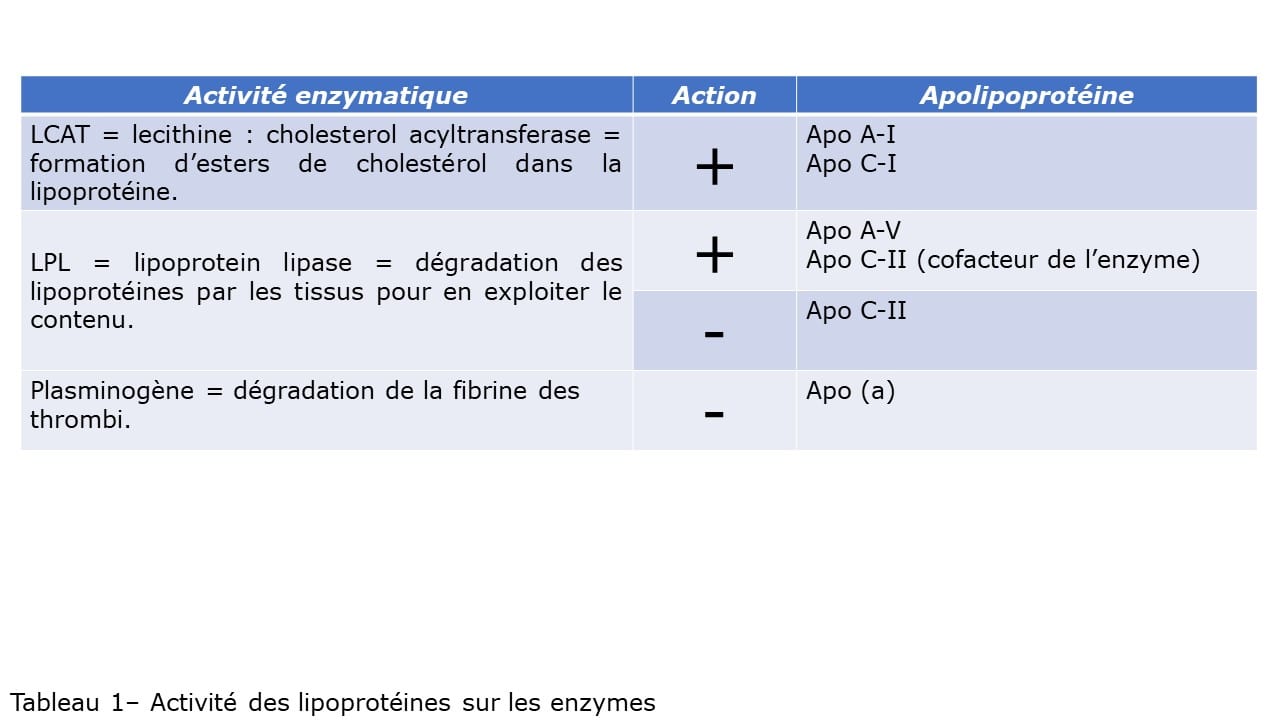
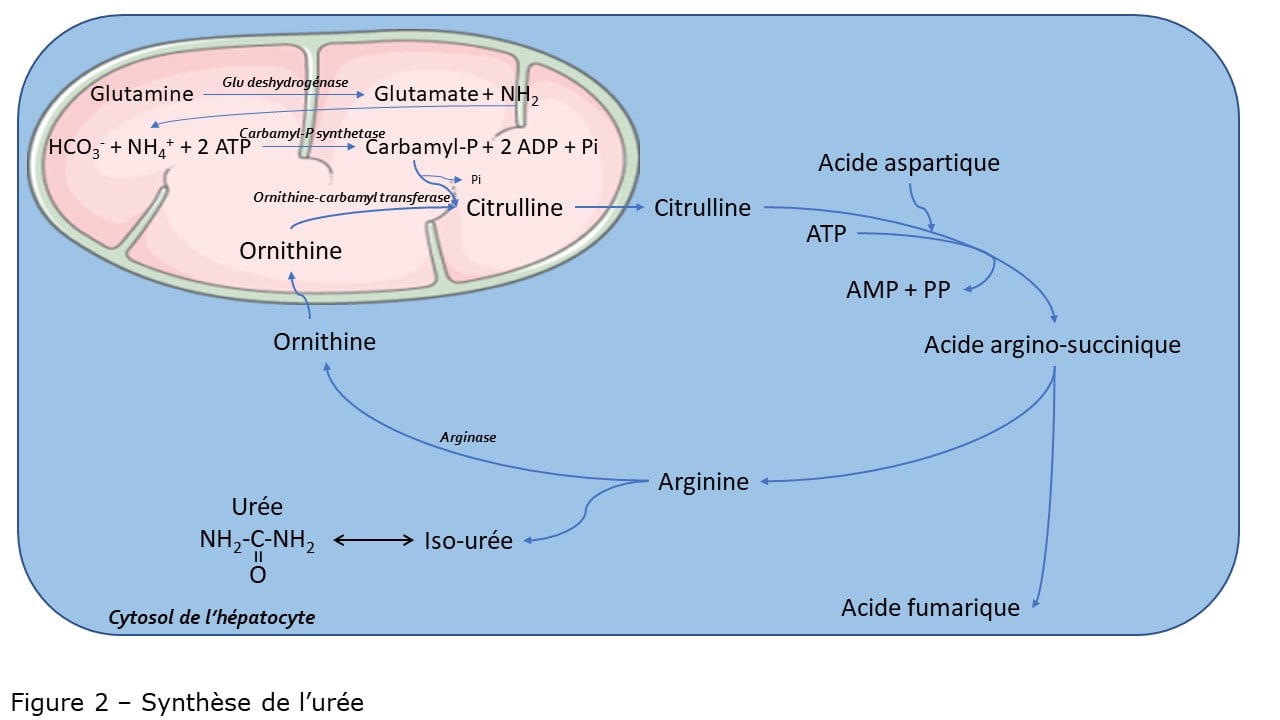
I-Introduction
Tous les organismes réalisant la digestion des aliments dans une lumière isolée du reste de l’organisme (tube digestif), sont confrontés à une difficulté : comment faire transiter les lipides alimentaires jusqu’aux zones où ils seront utilisés ? En effet, les organismes sont essentiellement composés d’eau (60 % chez l’Homme) et les lipides sont insolubles dans l’eau. Il n’est pas possible de faire circuler des micelles de lipides dans le sang sans risquer de provoquer une thrombose des plus petits vaisseaux.
Les modalités de circulation des lipides dans l’organisme dépendent de leur structure et de leur taille :
- Glycérol et acides gras (AG) à courtes chaînes (moins de 10 atomes de C) : après la digestion, la circulation dans le sang est libre depuis l’intestin vers le foie via la veine porte-hépatique ;
- Autres lipides : les lipides plus gros ou plus complexes (triglycérides par exemple) sont pris en charge par des protéines spéciales et transportés dans des sphères hermétiques. Cette méthode de transport est valable pour l’assimilation des lipides alimentaires (de l’intestin vers le foie et autres organes), ou pour la redistribution des lipides élaborés dans le foie (vers les organes).