Transformations lentes et rapides
Une réaction est dite instantanée lorsque l’évolution du système s’effectue en une durée inférieure à celle de la persistance rétinienne (0,1 seconde environ).
Exemple :
- Réaction de précipitation du chlorure d’argent-réaction acido-basique (dosage d’un acide par une base, par ex.).
Une réaction est dite lente si elle dure de quelques secondes à quelques années.
Exemple :
- Réaction d’oxydoréduction entre le dioxygène de l’air et le fer qui donne de l’oxyde de fer (la rouille).
Facteurs cinétiques
Les facteurs cinétiques sont les paramètres contrôlables susceptibles de modifier la durée d’une transformation.
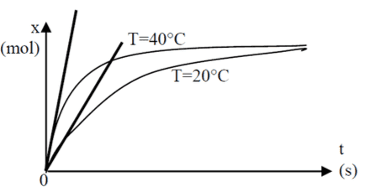
La vitesse de réaction à une date donnée est proportionnelle au coefficient directeur de la tangente à la courbe, donc l’étude des tangentes permet de comparer les vitesses de réaction.
Plus la température du milieu réactionnel augmente, plus la durée de transformation diminue.
 D’une manière générale, plus la concentration des réactifs dans le milieu réactionnel augmente, plus la durée de la transformation est faible.
D’une manière générale, plus la concentration des réactifs dans le milieu réactionnel augmente, plus la durée de la transformation est faible.

Les catalyseurs
Un catalyseur est une espèce chimique qui diminue la durée de réaction. Il n’apparait pas dans l’équation de réaction car sa quantité est identique à l’état initial et à l’état final.
On distingue 3 types de catalyse :
- La catalyse homogène : le catalyseur et les réactifs forment un mélange homogène ; ils se trouvent sous la même forme physique (solide, liquide ou gazeuse).
- La catalyse hétérogène : le catalyseur et les réactifs forment un mélange hétérogène (ils ne se trouvent pas sous la même forme physique). Le catalyseur est alors d’autant plus efficace qu’il est divisé (s’il est solide).
- La catalyse enzymatique : les réactions biochimiques sont catalysés par des macromolécules organiques appelées enzymes.
Temps de demi-réaction
Définition : Le temps de demi-réaction, noté $\rm t_{1/2}$, est la durée au bout de laquelle l’avancement $x$ atteint la moitié de sa valeur finale : $\color{black}{\boxed{x(\mathrm t_{1/2}) = \frac{x_f}{2}}}$. (Dans le cas d’une réaction totale, $x_f = x_{\rm max}$.

Vitesse volumique
La vitesse volumique de disparition d’un réactif s’exprime en $\rm mol.L^{-1}.s^{-1}$.
$\displaystyle \rm v_{disp}(R)_t = -\frac{d[R]}{dt}$
La vitesse volumique d’apparition d’un produit :
$\displaystyle \rm v_{app}(P)_t = \frac{d[P]}{dt}$
On peut déterminer ces vitesses en traçant la tangente à l’instant $\rm t$ à la courbe et en déterminant le coefficient directeur de cette tangente.
Loi de vitesse d’ordre 1
Une réaction est dite d’ordre 1 par rapport à un réactif $\rm A$ si la vitesse volumique de disparition de $\rm A$ est proportionnelle à la concentration en quantité de matière de ce réactif.
Soit $\rm v_{disp}(A)_t = k \times [A]_t$
Dans ce cas, la concentration du réactif $\rm A$ au cours du temps obéit à une loi exponentielle de la forme : $\rm [A]_t = [A]_0 \times exp (- k \times t)$


