Facteurs cinétiques
Influence de la température
Au niveau microscopique, une transformation chimique résulte des chocs efficaces (énergie suffisante pour rompre les liaisons chimiques) entre réactifs.
L’augmentation de la température se traduit au niveau microscopique par l’augmentation de l’agitation moléculaire. Il y a donc une augmentation de l’énergie cinétique des réactifs. Les chocs sont plus énergétiques et surtout plus fréquents.
Influence de la concentration
Bien que les chocs entre molécules soient aléatoires, plus la concentration des réactifs est élevée, plus la probabilité qu’ils se rencontrent augmente. Donc, la fréquence des chocs augmente, et ainsi la réaction est plus rapide.
Modélisation des interactions entre entités
Site accepteur de doublet d’électrons
Un site accepteur de doublet d’électrons est :
- un atome présentant un défaut d’électrons, c’est-à-dire possédant :
- soit une charge partielle positive $\delta +$
- soit une charge entière positive $+$
- un atome portant une lacune électronique
Site donneur de doublet d’électrons
- un atome présentant un excès d’électrons, c’est-à-dire possédant :
- soit une charge partielle négative $\delta -$
- soit une charge entière négative $-$
- une liaison double $\rm C= C$
- un atome portant un doublet non liant
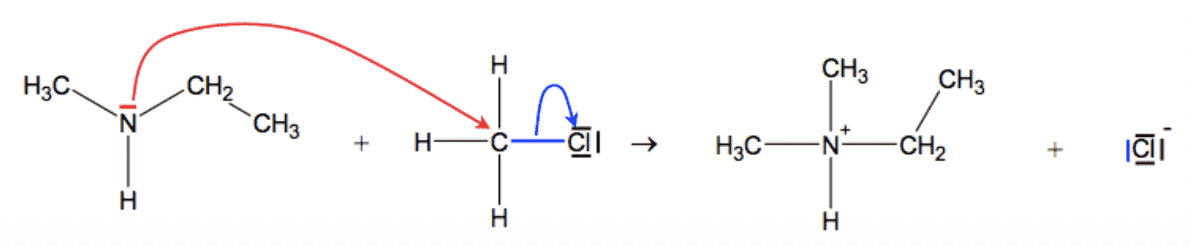
Flèche courbe
Au cours d’une étape d’un mécanisme réactionnel, le mouvement d’un doublet d’électrons traduisant la formation ou la rupture d’une liaison chimique est représentée par une flèche courbe.
Lors de la formation d’une liaison covalente, les électrons d’un doublet vont du site donneur vers le site accepteur (flèche rouge courbée ci-dessous).

Ainsi on observe la réaction suivante :