Réaction d’un acide ou d’une base avec l’eau
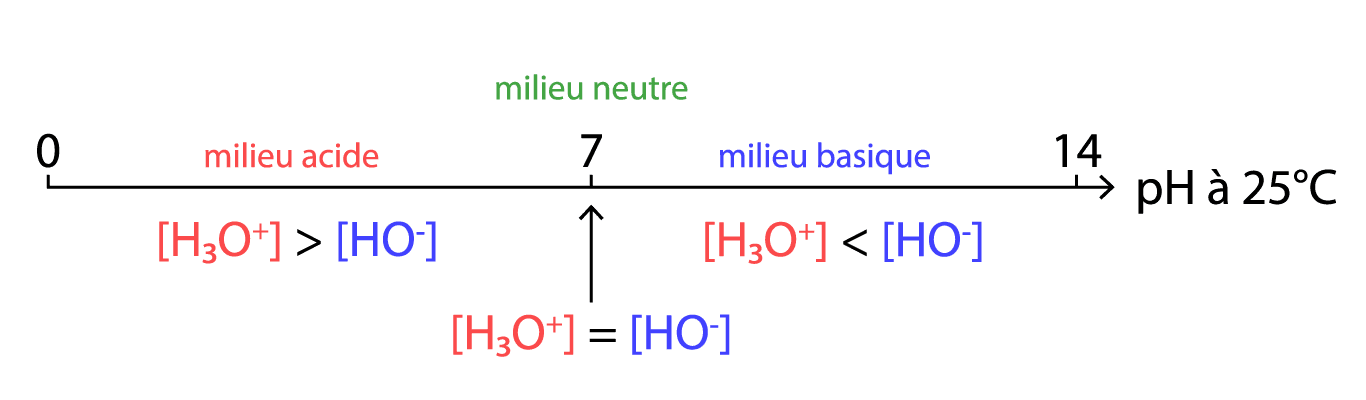
La constante d’équilibre de la réaction d’autoprotolyse de l’eau (ci-dessous) est appelée produit ionique de l’eau et notée $\rm Ke$.
$\rm \color{green}{H_2O(I)} \color{blue}{~+~} \color{red}{H_2O(I)} \color{blue}{~=~} \color{green}{H_3O^+_{(aq)}} \color{blue}{~+~} \color{red}{HO^-_{(aq)}}$
$\color{red}{\boxed{\begin{array}{ll}\color{black}{\rm Ke = [H_3O^+]_{éq} \times [HO^-]_{éq}}\\
\color{black}{\rm Ke= \color{red}{10^{-14}} \color{black}{\text{ à 25°C}}}\\
\color{black}{\rm \Rightarrow pKe = -\log (Ke) = \color{red}{14}}.\end{array}}}$
Solutions d’acide ou de base
Un acide $\rm AH$ est dit fort s’il réagit totalement avec l’eau.
$\rm AH_{(aq)} + H_2O \rightarrow A^-_{(aq)} + H_3O^+_{(aq)}$
Ces réactions sont caractérisées par une flèche simple entre les réactifs et les produits.
Une base $\bf A^-$ est dite forte si elle réagit totalement avec l’eau.
Le pH d’une solution d’acide fort de concentration $\rm C$ (en $\rm mol.L^{-1}$) est : $\bf pH = -\log (C)$
Le pH d’une solution de base forte de concentration $\rm C$ (en $\rm mol.L^{-1}$) est : $\bf pH = pKe + \log (C)$.
Un acide $\rm AH$ est dit faible s’il ne réagit pas totalement avec l’eau :
$\rm AH_{(aq)} + H_2O \leftrightarrows A^-_{(aq)} + H_3O^+_{(aq)}$
Une base $\rm A^-$ est dite faible si elle ne réagit pas totalement avec l’eau.
Chaque couple acide faible / base faible est caractérisé par une grandeur sans dimension nommée « constante d’acidité », notée $\bf K_A$, du couple $\rm AH / A^-$ :
$\displaystyle \rm K_A = \frac{[H_3O^+]_{eq}\cdot [A^-]_{eq}}{[AH]_{eq}}$ avec $\color{plum}{\boxed{\begin{array}{ll}\color{black}{\text{[Concentration] en } \rm mol.L^{-1}}\\
\color{black}{\rm K_A \text{ sans dimension}}\end{array}}}$
$\rm pK_A = -\log K_A$ et $\rm K_A = 10^{-pK_A}$
Solution tampon
Son pH varie peu par addition d’une petite quantité d’acide ou de base, et par dilution modérée.
Diagrammes d’un couple
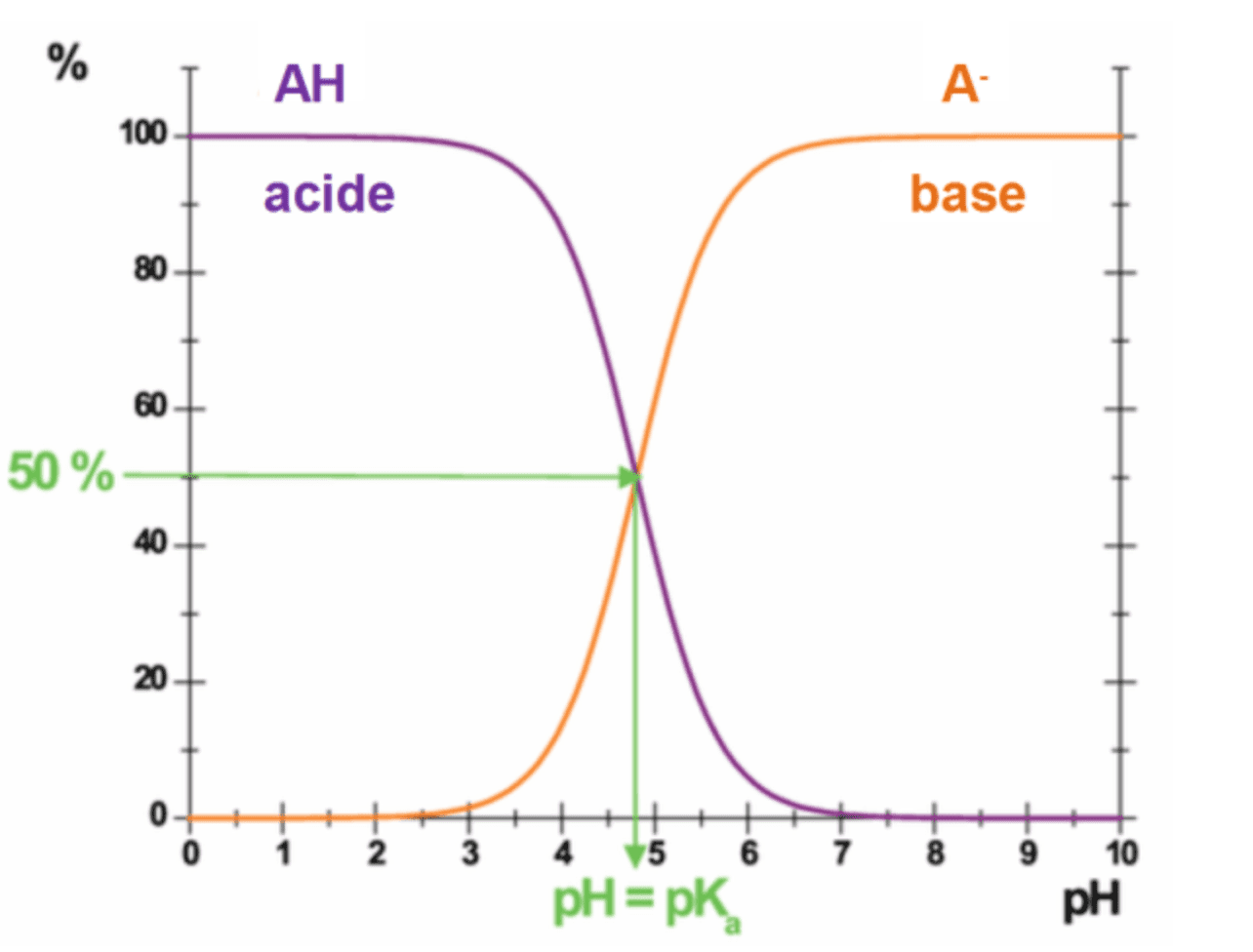
Diagramme de prédominance :
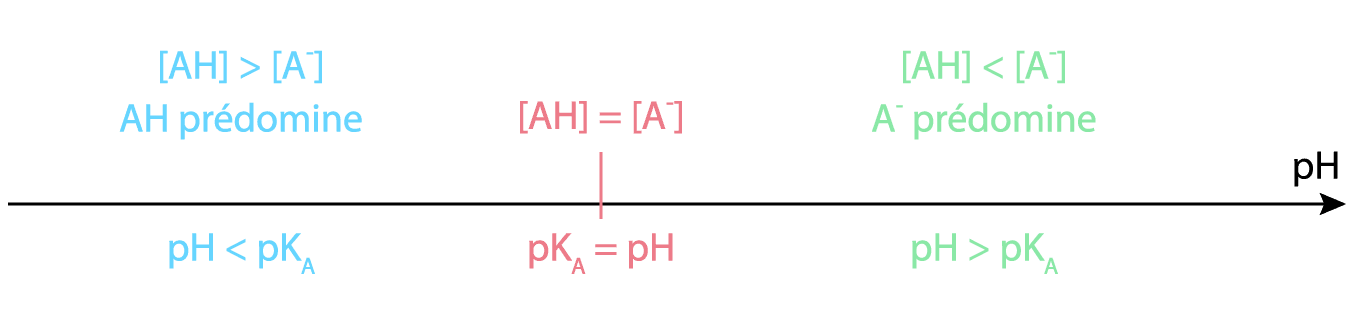 Diagramme de distribution :
Diagramme de distribution :