Acide
Un acide au sens de Brönsted est une espèce chimique capable de céder au moins un ion $\rm H^+$ (ou proton). On a : $\rm AH_{(aq)} \rightarrow A^-_{(aq)} + H^+_{(aq)}$.
Exemple d’acide : acide éthanoïque $\rm CH_3COOH_{(aq)}$, acide chlorhydrique $\rm H_3O^+_{(aq)} + Cl^-_{(aq)}$
Base
Une base au sens de Brönsted est une espèce chimique capable de capturer un proton. On a : $\rm A^- + H^+ \rightarrow AH$.
Exemple de base : ammoniac $\rm NH_{3_{(aq)}}$, hydroxyde de sodium $\rm Na^+_{(aq)} + HO^-_{(aq)}$
Couple Acide / base
Un couple acido-basique noté $\rm AH / A^-$ est constitué d’un acide $\rm AH$ et d’une base $\rm A^-$ liés par l’équation de l’équilibre de Brönsted : $\rm AH \Leftrightarrow H^+ + A^-$
Réactions acide / base
Une réaction acido-basique se produit lorsqu’un acide d’un couple (couple 1) cède un proton à la base d’un autre couple (couple 2).
On peut écrire $\rm Acide_1 + Base_2 \Leftrightarrow Base_1 + Acide_2$
Exemple :
On mélange de l’acide éthanoïque $\rm (CH_3COOH)$ avec de l’hydroxyde de sodium $\rm (Na^+ + HO^-)$.
L’acide cède un proton à l’ion hydroxyde : $\rm CH_3COOH \Leftrightarrow H^+ + CH_3COO^-$.
L’ion hydroxyde capte alors ce proton : $\rm HO^- + H^+ \Leftrightarrow H_2O$.
L’équation de cette réaction est donc : $\rm CH_3COOH + HO^- \Leftrightarrow CH_3COO^- + H_2O$
Couples à connaître
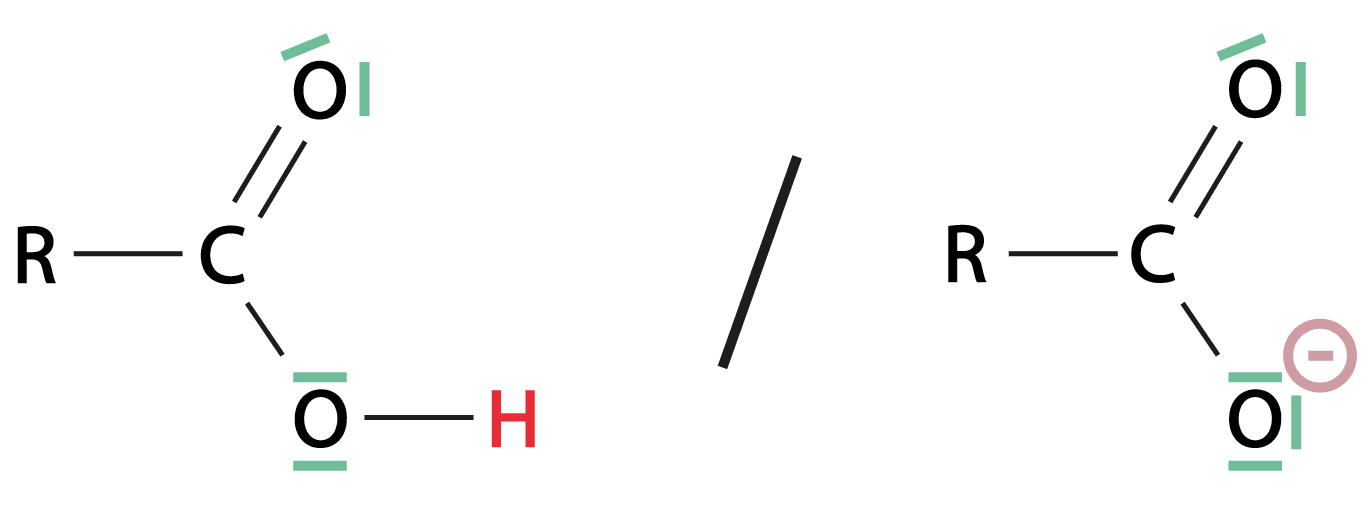
Couple des acides carboxyliques : Un acide carboxylique de formule $\rm RCO_2H$ cède un ion $\rm H^+$ pour former un ion carboxylate $\rm RCO_2^-$ selon l’équation $\rm RCO_2H = RCO_2^- + H^+$
Couple des amines : Ion ammonium/amine $\rm RNH{_3^+}_{(aq)} / RNH_{2_{(aq)}}$
Couple acide carbonique / ion hydrogénocarbonate : $\rm CO_2$, $\rm H_2O_{(aq)} / HCO{_3^-}_{(aq)}$.
Espèce amphotère
Une espèce amphotère est à la fois l’acide d’un couple et la base d’un autre couple.
Exemple : $\rm H_2O / HO^-$ et $\rm H_3O^+ / H_2O$.
Schéma de Lewis
Dans la molécule d’acide carboxylique, le départ de l’atome d’hydrogène $\rm H$ lié à l’atome d’oxygène est favorisé par la différence d’électronégativité entre $\rm O (\chi= 3,4)$ et $\rm H (\chi= 2,2)$.
pH d’une solution
Le pH d’une solution est mesuré avec un pH-mètre. Le pH augmente si la concentration en ions oxonium diminue et inversement.
$\displaystyle \rm pH = - \log \left(\frac{[H_3O^+]}{c°}\right)$ avec $\rm pH$ sans unité, $\rm c°$ concentration standard $\rm c° = 1~mol.L^{-1}$, $\rm [H_3O^+]$ concentration en quantité d’ions oxonium en $\rm mol.L^{-1}$.
$\rm[H_3O^+] = 10^{-pH} \times c°$


