Schéma de Lewis d’un atome ou d’un ion monoatomique :
Exemple : atome d’oxygène $\rm O$ $\rm Z=8$ $\rm 1s^22s^22p^4$, configuration électronique la plus proche $\rm 1s^22s^22p^6$ donc il manque $2$ électrons d’où $2$ doublets liants. $6$ électrons de valence dont $2$ forment des doublets liants donc $6 - 2 = 4$ soit $2$ doublets non liants.
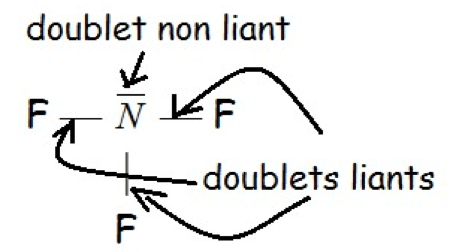
Autre exemple : atome d’azote $\rm N$ $\rm 1s^22s^22p^3$, configuration électronique la plus proche $\rm 1s^22s^22p^6$ donc il manque $3$ électrons d’où $3$ doublets liants. $5$ électrons de valence dont $3$ forment des doublets liants donc $5 - 3 = 2$ soit $1$ doublet non liant.
Les électrons de valence sont représentés par des points s’ils sont célibataires et un tiret s’ils forment un doublet.
Exemple : Ion chlorure $\rm Cl^-$ , gain d’ un électron par rapport à l’atome de chlore configuration électronique $\rm 1s^22s^22p^63s^23p^6$.
Schéma de Lewis d’une molécule :
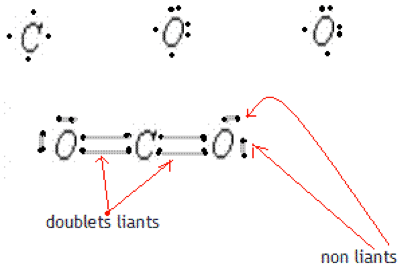
Au sein d’une molécule, les atomes se lient grâce à des liaisons covalentes, mise en commun de deux électrons de leurs couches externes. Ces $2$ électrons forment un doublet liant. La liaison covalente se représente par un tiret entre les symboles des deux atomes.
Les atomes forment des liaisons covalentes pour acquérir une structure stable identique à celle des gaz nobles ($2$ électrons sur leur couche externe, règle du duet ou $8$ électrons sur leur couche externe, règle de l’octet).
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d’électrons qui manque sur sa couche externe pour respecter la règle du duet ou ma règle de l’octet.
Il existe $2$ types de doublet d’électrons :
- Le doublet liant constitué de deux électrons mis en commun dans une liaison covalente.
- Le doublet non liant, formé de deux électrons de la couche externe des atomes, qui ne participent pas aux liaisons entre atomes.
La représentation de Lewis représente les doublets liants et non liants d’une molécule. Les doublets liants se représentent par un trait entre les symboles des atomes et les doublets non liants se représentent par un trait à côté du symbole de cet atome.
Schéma de Lewis de la molécule de dioxyde de carbone :
Schéma de Lewis d’un ion polyatomique :
Un atome engagé dans un ion porte une charge formelle s’il n’est pas entouré du même nombre d’électrons qu’à l’état isolé.
Si le doublet non liant d’un atome devient un doublet liant, l’élément porte alors une charge positive.
Exemple : L’ion oxonium $\rm H_3O^+$, un des doublets non liants de l’oxygène s’est transformé en doublet liant. L’élément oxygène porte une charge positive.
Si le doublet liant d’un atome devient un doublet non liant, l’élément porte alors une charge négative.
Exemple : L’ion hydroxyde $\rm HO^-$ , un des doublets liants de l’oxygène s’est transformé en doublet non liant. L’élément oxygène porte une charge négative.
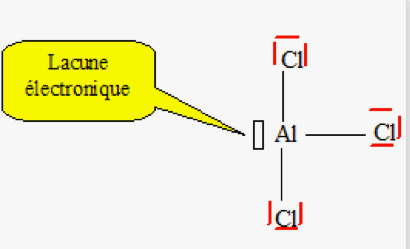
Lacune électronique :
Une lacune correspond à l’absence d’un doublet d’électrons par rapport aux règles de stabilité. Elle est représentée par un rectangle vide à côté du symbole de l’élément.
Théorie VSEPR :
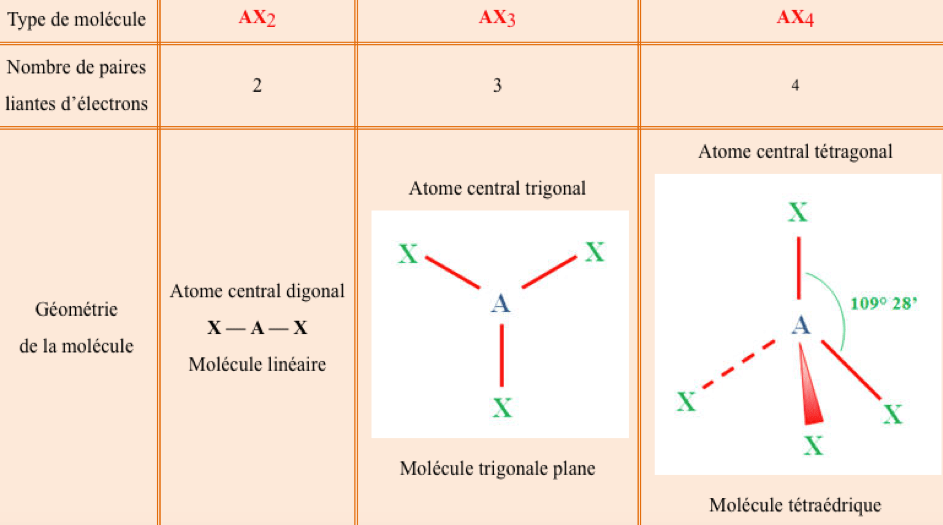
La méthode VSEPR s’applique à des molécules ou des ions du type :
$\bf AX_nE_p$
$\bf A$ désigne l’atome central qui est lié à $\bf n$ atomes $\bf X$ et qui possède $\bf p$ paires d’électrons libres (ou $\bf p$ doublets non liants).
► Exemples :
La géométrie d’une molécule ou d’un ion dépend du nombre total de paires d’électrons (doublets d’électrons) de la couche de valence de l’atome central $\bf A$. Les paires d’électrons de la couche de valence de l’atome central se disposent de façon à ce que leurs répulsions mutuelles soient minimales (c’est-à-dire que leurs distances soient maximales).