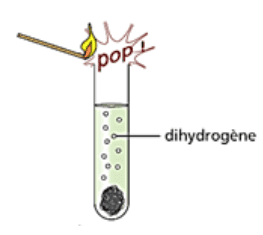
Test de présence de dihydrogène
Il est possible de tester la présence de dihydrogène dans un gaz. Il suffit alors d’approcher une flamme du gaz. S’il se produit une détonation ressemblant à un aboiement, alors le gaz contenait du dihydrogène.
Test de reconnaissance des ions
Il est possible d’identifier les ions contenus dans une solution. Pour cela, il faut ajouter un réactif puis observer le résultat. Si un précipité se forme, alors l’ion testé est présent. Nous trouvons la liste des réactifs et des précipités attendus dans la littérature (qui n’est pas à apprendre par cœur). Voici un extrait :
Si le précipité n’apparaît pas, alors la solution ne contient pas l’ion testé. Elle peut cependant en contenir d’autres.