Décrire et expliquer des transformations chimiques 2
📝 Mini-cours GRATUIT
Associer le caractère acide ou basique à la présence d’ions H+ et OH-
Identifier les gaz à effet de serre produits lors de transformations chimiques
Ions H+ et OH-
Réactions de corrosion d’un métal
🍀 Fiches de révision PREMIUM

Chimie / La matière
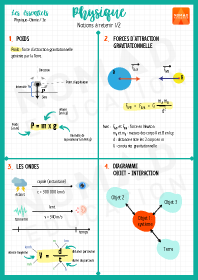
Physique
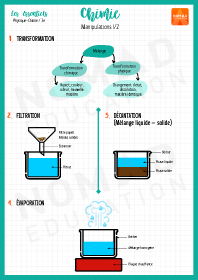
Chimie / Manipulations

Chimie / Caractérisation
📄 Annales PREMIUM

Annales 2021 Métropole (Sciences 3e)

Annales 2021 Centres Etrangers 1 (Sciences 3e)

Annales 2021 Centres Etrangers 2 (Sciences 3e)

Annales 2019 Métropole

Sujet d'annales de Sciences 2022 Métropole – Série professionnelle

Corrigé d'annales de Sciences 2022 Métropole – Série professionnelle

Annales corrigées Métropole 2023 – Sciences pro

Annales corrigées Métropole 2024 – Sciences



