Décrire et expliquer des transformations chimiques
📝 Mini-cours GRATUIT
Interpréter une transformation chimique comme une redistribution des atomes
Utiliser une équation de réaction chimique fournie pour décrire une transformation chimique observée
Conservation de la masse lors d’une transformation chimique
Notions de molécules, atomes – Partie 1
Notions de molécules, atomes – Partie 2
Associer leurs symboles aux éléments à l’aide de la classification périodique
🍀 Fiches de révision PREMIUM
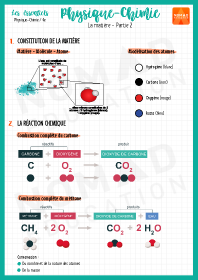
La matière – Partie 2
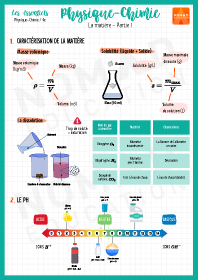
La matière – Partie 1



