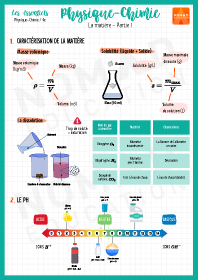
Rappel : la formule de la masse volumique est :
ρ=mV
Déterminer la masse volumique d’un liquide :
- Peser une éprouvette graduée à vide, noter la masse méprouvette vide
- Mesurer Vliquide = 100 mL de ce liquide à l’éprouvette graduée
- Peser l’éprouvette graduée pleine, noter la masse méprouvette pleine
La masse du liquide est donc: mliquide =méprouvette pleine −méprouvette vide
Le volume du liquide est Vliquide=0,1L
La masse volumique du liquide est ρliquide =mliquide Vliquide , mesurée en g/L
Déterminer la masse volumique d'un solide :
- Peser le solide, noter la masse (attention, tarer la balance avec la coupelle de pesée) msolide
- Insérer un volume d'eau suffisamment grand dans une éprouvette graduée pour couvrir tout le solide, noter le volume à vide Vvide
- Insérer délicatement le solide dans l'éprouvette graduée, noter le volume plein Vplein
La masse du solide est celle mesurée à la balance : msolide
Le volume du solide est Vsolide =Vplein −Vvide
La masse volumique du solide est ρsolide =msolide Vsolide , mesurée en g/L
À noter que l’unité internationale de la masse volumique est kg/m3, mais que nous utilisons en pratique l’unité g/L en chimie.