Solubilité
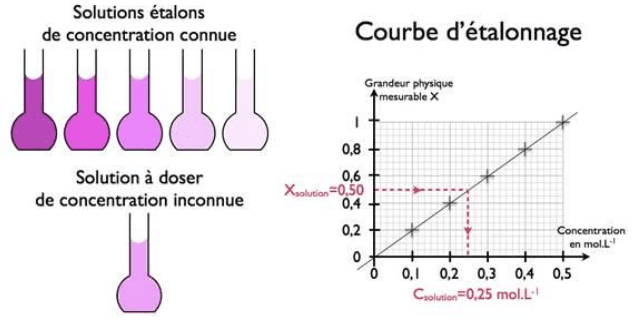
Une solution est constituée d’un soluté (en plus petite quantité) et d’un solvant (en quantité majoritaire). Il est possible d’extraire un soluté grâce à un autre solvant.
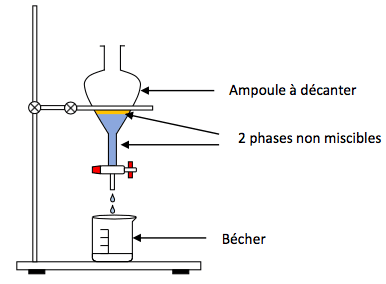
Dans une solution aqueuse, nous choisirons un solvant qui n’est pas miscible à l’eau mais dans lequel le soluté aura une bonne solubilité. Ainsi, le soluté à extraire passera dans le solvant, puis il sera possible de séparer la phase aqueuse de l’autre phase grâce à une décantation.
Pour choisir un bon solvant, il faut également que le soluté soit plus soluble dans ce solvant que dans l’eau. La phase ayant la densité la plus grande se retrouvera au fond de l’ampoule et celle qui aura la densité la plus faible se retrouvera en haut de l’ampoule.
Schéma de la décantation :
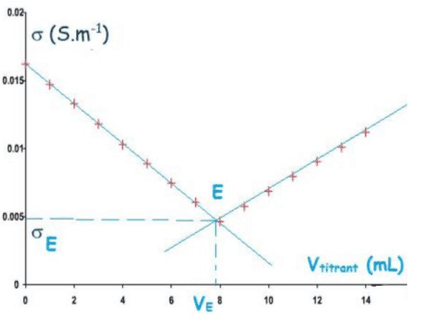
Dosage par titrage d’une solution
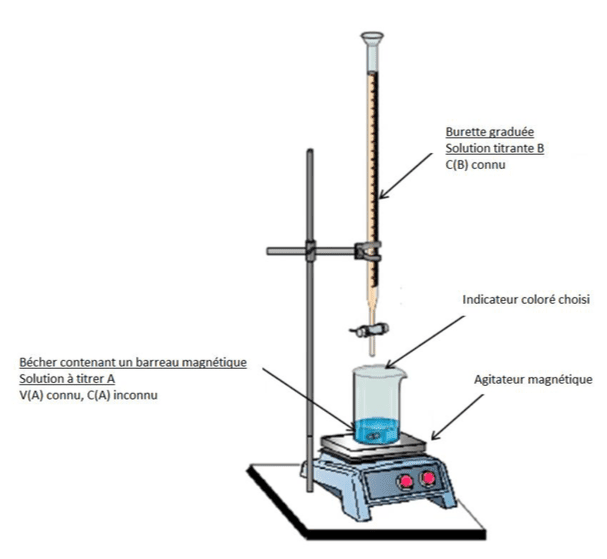
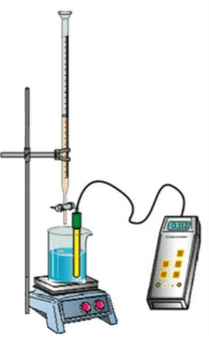
Le titrage est une méthode de dosage qui permet de déterminer la concentration d’une solution en la faisant réagir avec un réactif. Attention, cette méthode est destructive.
Titrage colorimétrique
L’équivalence (lorsque tous les réactifs sont en proportions stœchiométriques) est déterminée par le changement de couleur de la solution à titrer.
Montage :
Si nous avons la réaction de titrage suivante :
aA+bB→cC+dD
à l’équivalence, nous avons versé un volume VE se solution titrante :
nAa=nBb
Le plus souvent, a et b valent 1. Nous avons donc :
𝐶A×𝑉A=𝐶B×𝑉E d’où
CA=CB×VEVA