La corrosion des métaux
Même si, de nos jours, les véhicules sont de plus en plus légers parce qu’ils contiennent moins de métaux que les anciens modèles, ces métaux doivent être protégés de la corrosion.
En effet, la corrosion est une réaction chimique naturelle d’oxydoréduction qui détériore les métaux au fil du temps. Cette détérioration est accentuée avec l’oxygène de l’air ainsi qu’avec d’autres facteurs tels que l’eau et le sel. Lors de la corrosion, les métaux s’oxydent.
Réaction chimique d’oxydoréduction
Lorsque les métaux s’oxydent, ils subissent une réaction d’oxydoréduction (rédox) au cours de laquelle intervient un transfert d’électrons : un métal qui s’oxyde est un métal qui perd des électrons.
Lors d’une telle réaction, le métal, appelé réducteur, subit l’attaque d’un agent oxydant : l’agent oxydant prend des électrons au métal qui devient oxydé. L’agent oxydant devient alors réduit.
Ainsi, une réaction d’oxydoréduction fait intervenir deux éléments qui passent respectivement d’une forme à une autre au cours de la réaction :
- L’oxydant devient réduit ;
- Le réducteur (métal) devient oxydé.
On désigne donc deux couples rédox mis en jeu dans la réaction :
- Oxydant(1)/réducteur(1) : l’oxydant(1) devient réducteur(1) ;
- Oxydant(2)/réducteur(2) : le réducteur(2) devient oxydant(2).
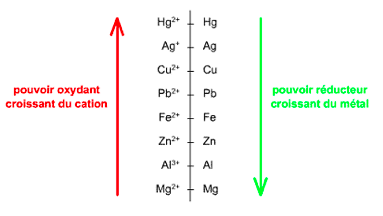
Pour prévoir si une réaction rédox est possible entre deux éléments, on utilise une classification électrochimique, où les éléments sont classés en fonction de leur pouvoir oxydant.
Exemple avec le cuivre et le zinc :
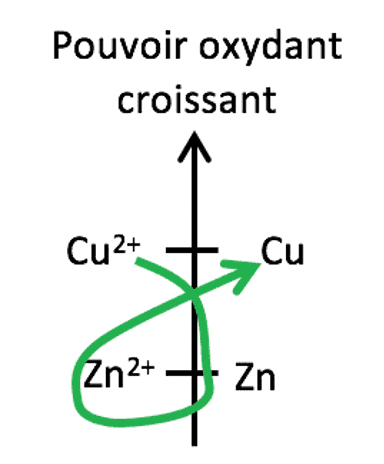
Entre le cuivre oxydant (CU2+) et le zinc réducteur (Zn), une réaction rédox peut avoir lieu : la lettre gamma (γ) peut être tracée sur l'extrau de classification électrochimique.
Écrire et équilibrer une équation bilan rédox
Soit une réaction rédox entre l’ion argent Ag+ et le zinc métallique Zn.
Sur la classification électrochimique, la règle du gamma s’applique et confirme donc que l’argent est plus oxydant que le zinc :

Couples rédox mis en jeu : Ag+/Ag et Zn2+/Zn
Demi-équations :
1. Ag++e−=Ag
2. Zn2++2e−=Zn
Attention : l’énoncé précise qu’il s’agit d’une réaction entre l’ion argent Ag+ et le zinc métallique Zn. Il faut donc écrire les demi-équations dans le sens de la réaction :
1. Ag++e−→Ag
2. Zn→Zn2++2e−
Ag+ et Zn subissent tous deux une transformation.
Attention : le nombre d’électrons captés par Ag+ doit correspondre au nombre d’électrons fournit par Zn. Il faut donc multiplier par 2 la demi-équation 1. :
1. (Ag++e−→Ag)×2
2. Zn×Zn2++2e−
L’équation bilan s’obtient alors en additionnant membre à membre les deux demi-équations :
1. 2Ag++2e−→2Ag
2. Zn→Zn2++2e−
Après simplification des électrons, on obtient l’équation bilan :
2Ag++Zn→2Ag+Zn2+
- L’ion Ag+ devient Ag métallique : il subit une réduction et devient réduit.
- Le zinc métallique Zn devient l’ion Zn2+ : il subit une oxydation et devient oxydé.