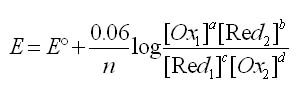Un oxydant est une espèce chimique capable de gagner un ou plusieurs électrons. Lors d'une réaction d'oxydoréduction spontanée un oxydant de pouvoir oxydant supérieur à un autre oxydant réagit avec le réducteur conjugué de de second oxydant selon la règle du gamma. Une méthode permettant de trouver rapidement cette réaction spontanée est la règle du gamma. La branche descendante du γ relie les réactifs tandis que la branche ascendante indique les produits de la réaction spontanée possible. Lors d'une réaction d'oxydoréduction , on a Ox + ne- = Red avec le couple Ox/Red. L'oxydant subit une réduction.
L'équation de Nernst permet de calculer le potentiel d'un couple rédox
Soit la demi-pile :
a Ox + n e- = b Red
L'équation de Nernst s’écrit :
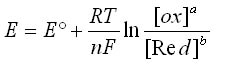
Avec :
- E°: le potentiel standard en Volt
- R : constante des gaz parfaits - R = 8,3145 J·mol-1·K-1
- T : la température en Kelvin (K)
- F : la constante de Faraday = 96 485 C.mol-1
- N : le nombre d’électron échangés
Dans le cas d'un système rédox
aOx1 + bRed2 + ne-
![]() cRed1 + dOx2
cRed1 + dOx2
L’équation de Nernst s’écrit :