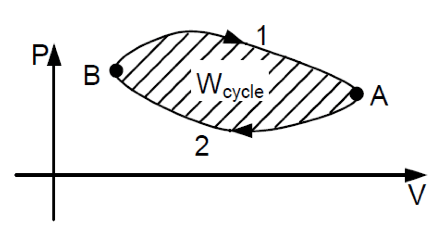
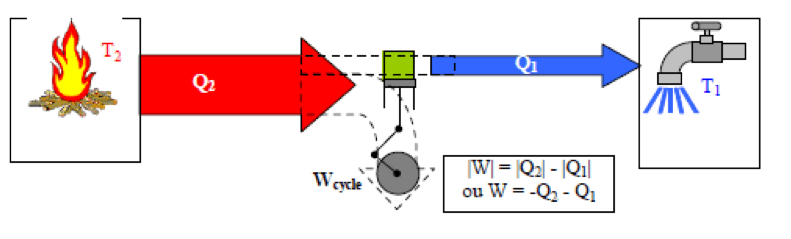
La thermodynamique permet d’étudier, entre autres, le déplacement d’un corps soumis à la chaleur (ex : moteurs thermiques) ou inversement, la chaleur captée ou rejetée par un corps soumis à une déformation ou un déplacement (ex : climatisation)
Les transformations thermodynamiques provoquent une variation soit de T°, soit de pression, soit de volume du système considéré. Ces grandeurs sont liées par un certain nombre de relations.
Loi des gaz parfaits
P.V=n.R.T
Notions importantes
Différence entre chaleur et température
Un corps n'a pas une quantité de chaleur Q déterminée (contrairement à la température) : la quantité de chaleur perdue ou gagnée est fonction des corps ou systèmes avec lesquels il interagit et en fonction du type de transformation.
Quantité de chaleur Q
Elle est égale à la variation d'énergie thermique du corps.
Si tf>ti : le corps s'est échauffé, il a reçu de l'énergie et Q est positive.
Si tf<ti : le corps s'est refroidi, il a donné de l'énergie et Q est négative.
Capacité calorifique massique C :
Elle intervient dans le calcul de la quantité de chaleur Q perdue ou gagnée.
C d'un corps est la quantité de chaleur qu'il faut fournir (ou prendre) à l'unité de masse de ce corps pour que sa température s'élève (ou s'abaisse) de 1° K
Pour céder Q, un corps dont C est petit doit beaucoup se refroidir, si C est élevé il se refroidit peu.
Expérience de Joule
Joule a montré que l’élévation de température d’un liquide peut être provoquée par un apport d'énergie mécanique (ex : Faire tourner une cuillère dans un verre d’eau)
Joule a démontré que l’unité de Q doit s’exprimer en Joules comme celle du travail mécanique W
Chaleur Latente (J/Kg) :
Elle traduit l’inertie du corps (l’opposition) du corps à changer de phase. C’est la chaleur que doit perdre ou gagner le corps pour que le changement de phase s’effectue (ex : vaporisation), et non pas pour augmenter sa température.
Pouvoir calorifique (Chaleur massique de combustion)
Le pouvoir calorifique est la quantité d’énergie fournie par la combustion d’un corps (c’est la conversion d’énergie chimique en chaleur).
Ex : L’essence apporte une chaleur qui est dégagée lors de sa combustion Qc=Messence×Lcombustion
Travail des forces de pression
Les gaz sont des systèmes dont le volume varie beaucoup en fonction des échanges de chaleur.
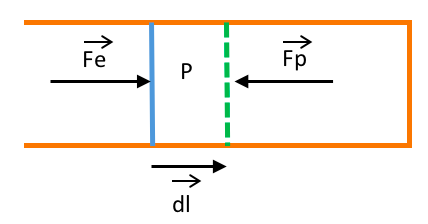
Fp : Force de pression
P : Pression du gaz
dl : Déplacement dû à Fe
Fe : Force extérieure
S : Section du piston
Un cylindre renferme un gaz à la pression P.
Le gaz exerce alors une force pressante Fp=P.S
La variation du travail de Fp du au déplacement dl vaut : dW=−P.dV dV:variation du volume de gaz
Compression : dV<0 (le volume diminue) => dW>0 le gaz reçoit du travail.
Détente : dV>0 (le volume augmente) => dW<0 le gaz fournit du travail au milieu extérieur.