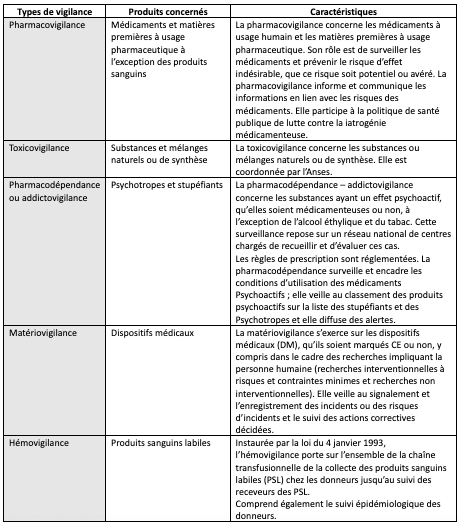
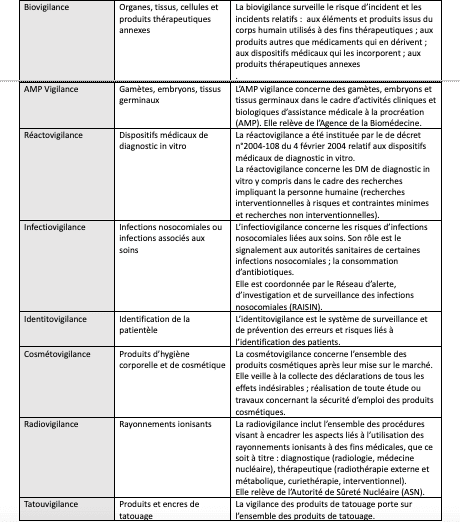
Chaque vigilance réglementaire est organisée selon un circuit précis, avec un signalant, un correspondant et une instance locale, en articulation avec les instances régionales et nationales.
Les vigilances sont organisées autour de différents échelons interagissant les uns avec les autres :
- Au niveau de l’échelon national : ANSM, Agence de la Biomédecine (biovigilance) et Réseau des Centres d’Évaluation et d’Information sur la Pharmacodépendance (CEIP) ;
- Au niveau de l’échelon régional : Centres Régionaux de Pharmacovigilance (CRPV), Coordonnateurs Régionaux de Matériovigilance et Réactovigilance (CRMRV) et Centres d’Évaluation et d’Information sur la Pharmacodépendance – Addictovigilance (CEIP-A) ;
- Au niveau de l’échelon local : Correspondant Local de Matériovigilance (CLMV), Correspondant d’hémovigilance et de sécurité transfusionnelle des établissements de transfusion sanguine, des établissements de santé, Correspondant local de Biovigilance.
L’Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM) est chargée de coordonner les vigilances sanitaires.
Santé publique France a pour mission de surveiller et de prévenir ces infections en établissements de santé, établissements médico-sociaux et soins de ville, contribuant ainsi à en limiter l’impact. La surveillance du risque infectieux est attribuée à Santé publique France et dans chaque établissement de santé au Comité de Lutte Contre les Infections Nosocomiales (CLIN).
Les patients qui recourent à une assistance médicale à la procréation (AMP) peuvent se trouver confrontés à des risques d’événements indésirables, parfois graves. Il peut s’agir, par exemple, de syndromes d’hyperstimulation ovarienne ou de complications opératoires, ou encore de perte de chance liée à des défauts matériels ou à des problèmes d’étiquetage. La loi de bioéthique a prévu la mise en place d’un dispositif d’AMP vigilance dans lequel les professionnels de santé ont l’obligation de déclarer tout événement indésirable survenant au cours d’une procédure d’AMP.
Le Code de la Santé Publique à l’article L1413-14CSP stipule l’OBLIGATION aux professionnels de santé de signaler tout événement ou incident dont ils sont témoins aux autorités sanitaires directement ou par l’intermédiaire du correspondant local. L’absence de déclaration est passible de 4 ans de prison et/ou 76 000 € d’amende.