QU’EST-CE QU’UN ISOMÈRE ?
Des isomères sont des composés chimiques qui possèdent la même formule brute, mais dont les atomes sont combinés différemment les uns avec les autres.
Parmi les isomères, on distingue les isomères de constitution et les stéréoisomères.
LES ISOMÈRES DE CONSTITUTION
Ces isomères ont des formules développées différentes, soit par :
1. leurs chaînes carbonées (isomères de chaîne)
Exemple pour deux molécules de formule brute $\mathrm{C_4H_{10}}$ :
 Butane
Butane
 2-méthylpropane
2-méthylpropane
2. la position de leur fonction (isomères de position)
Exemple pour deux molécules de formule brute $\mathrm{C_3H_8O}$ :
 Propan-1-ol
Propan-1-ol
 Propan-2-ol
Propan-2-ol
3. leurs fonctions chimiques (isomères de fonction)
Exemple pour deux molécules de formule brute $\mathrm{C_3H_8O}$ :
 Propan-1-ol
Propan-1-ol
 1-méthoxyéthane
1-méthoxyéthane
LES STÉRÉOISOMÈRES
Ces isomères ont la même formule semi-développée mais diffèrent par la position, dans l’espace, de leurs substituants.
Parmi ces isomères, on distingue les isomères de conformation et les isomères de configuration.
1. Isomères de conformation
Ces isomères représentent la multitude des structures spatiales qu’une molécule peut adopter du fait de la présence d’une liaison carbone-carbone et de la rotation plus ou moins libre des groupements autour de cette liaison. Ces isomères ne peuvent pas être séparés chimiquement.
Exemple avec le butane :
 Conformation décalée
Conformation décalée
 Conformation éclipsée
Conformation éclipsée
En conformation décalée, les groupes $\mathrm{CH_3}$ sont les plus éloignés possibles, conférant une plus grande stabilité à la structure (énergie basse).
En conformation éclipsée, les groupes $\mathrm{CH_3}$ sont les plus proches possibles, conférant une plus grande instabilité à la structure (énergie haute).
Exemple avec le cyclohexane :
 Conformation chaise
Conformation chaise
 Conformation bateau
Conformation bateau
La conformation chaise est plus rigide car plus stable (énergie basse) que la conformation bateau, plus flexible (énergie plus haute).
2. Isomères de configuration
Contrairement aux isomères de conformation, il n’est pas possible de passer d’un isomère de configuration à un autre, à moins de briser une ou des liaisons chimiques. Ces isomères peuvent être isolés chimiquement, par des techniques de séparation appropriées.
On distingue les énantiomères des diastéréoisomères.
A- Énantiomères
Deux isomères sont énantiomères si l’un est l’image de l’autre dans un miroir plan. Ce sont donc des inverses optiques. Ils réagissent chimiquement de la même façon et ont les mêmes propriétés physiques, seuls leurs pouvoirs rotatoires sont opposés.
Exemple avec l’acide 2-aminopropanoïque :
 acide (R)-2-aminopropanoïque - acide (S)-2-aminopropanoïque
acide (R)-2-aminopropanoïque - acide (S)-2-aminopropanoïque
B- Diastéréoisomères
Si deux isomères de configuration ne sont pas énantiomères, alors on les appelle diastéréoisomères. Leurs propriétés chimiques et physiques sont différentes.
Exemple avec le 2-bromobut-2-ène :
 (Z)-2-bromobut-2-ène
(Z)-2-bromobut-2-ène
 (E)-2-bromobut-2-ène
(E)-2-bromobut-2-ène
La configuration Z/E s’applique pour des molécules portant une liaison double carbone-carbone et des substituants différents sur ces carbones. On classe les substituants de chaque carbone sp2 selon les règles de Cahn, Ingold et Prelog : si, dans le plan de la double liaison, les deux substituants de plus forte priorité sont regroupés (au-dessus ou en-dessous de cette double liaison), la configuration est Z (de l’allemand zusammen : ensemble). Dans le cas contraire, elle est E (de l’allemand entgegen : opposé).


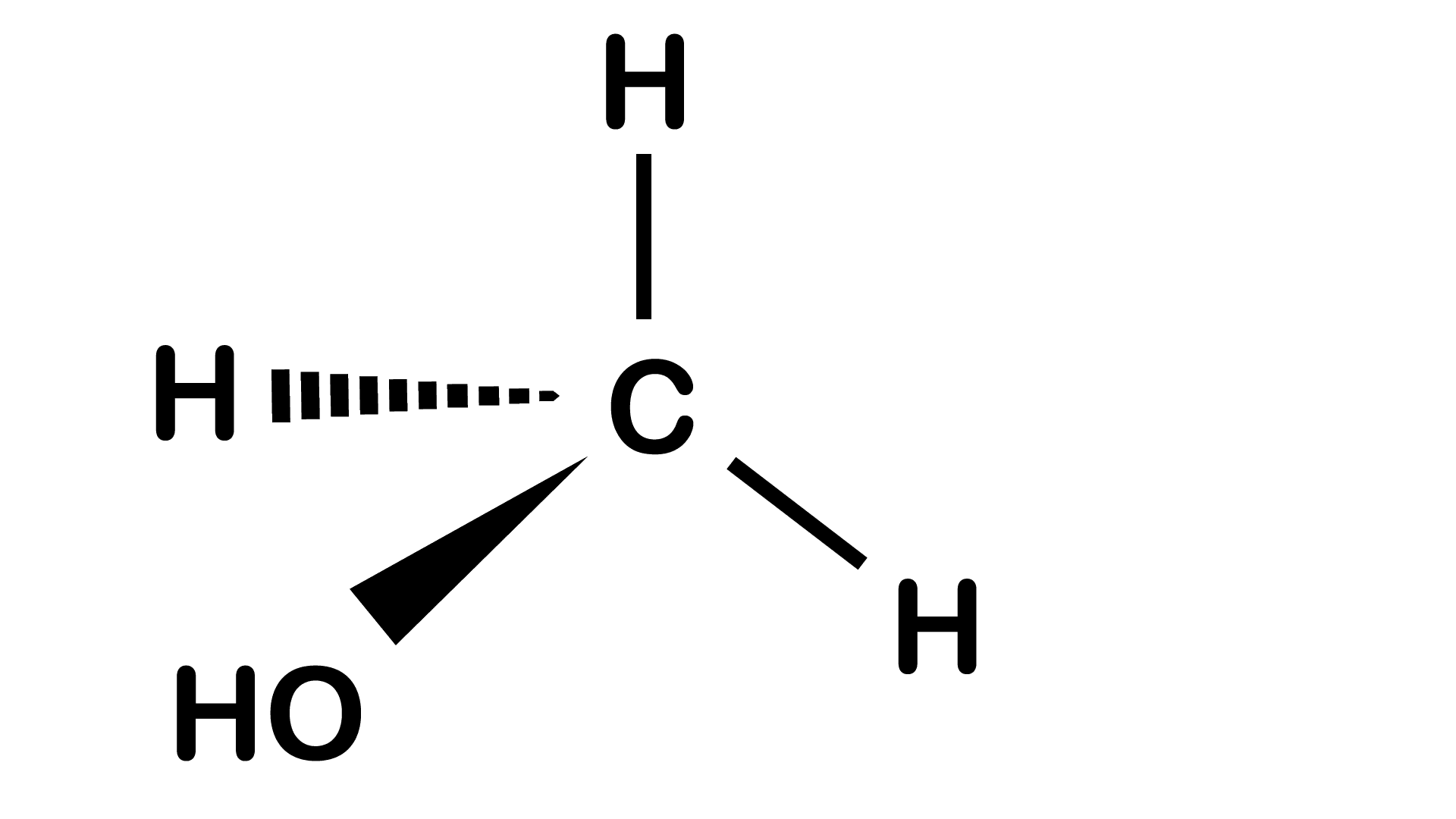











 2-méthylpropane
2-méthylpropane Propan-2-ol
Propan-2-ol Conformation décalée
Conformation décalée  Conformation éclipsée
Conformation éclipsée Conformation chaise
Conformation chaise  Conformation bateau
Conformation bateau acide (R)-2-aminopropanoïque - acide (S)-2-aminopropanoïque
acide (R)-2-aminopropanoïque - acide (S)-2-aminopropanoïque (Z)-2-bromobut-2-ène
(Z)-2-bromobut-2-ène  (E)-2-bromobut-2-ène
(E)-2-bromobut-2-ène


