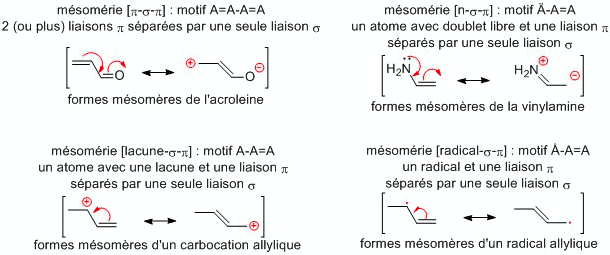
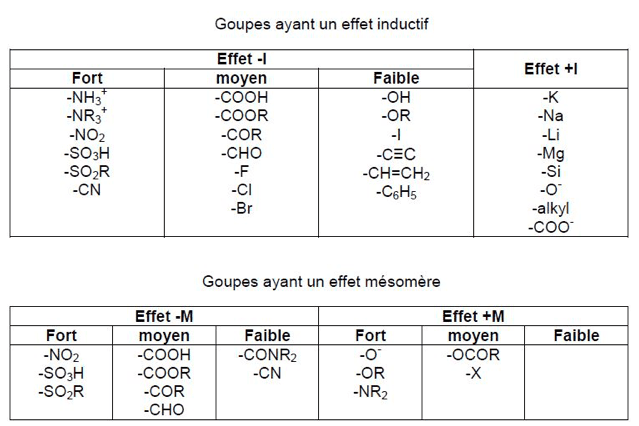
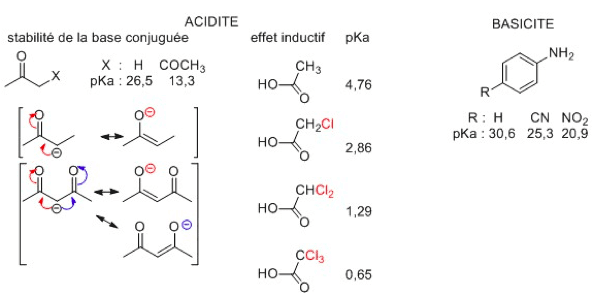
Effets électroniques
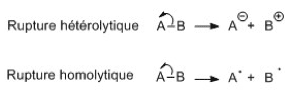
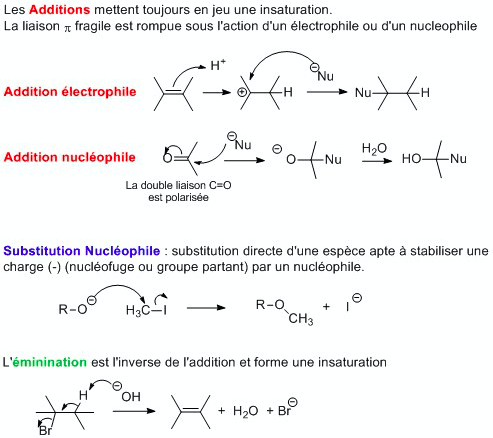
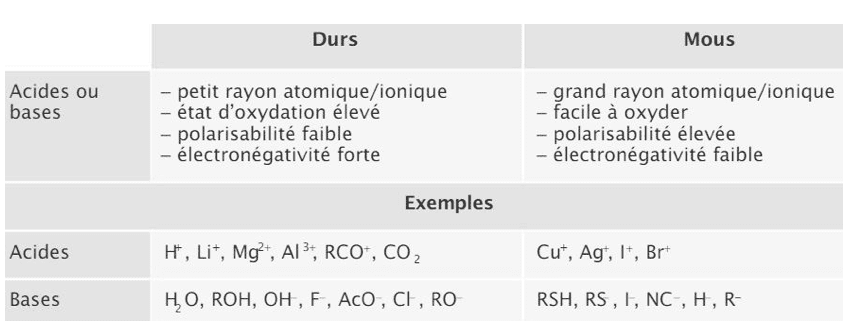
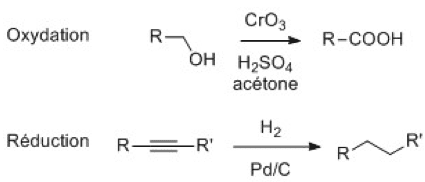
- Effets inductifs : la liaison σ entre deux atomes d’électonégativité différente est polarisée (charge partielle δ+ sur l’atome le moins électronégatif, δ- sur le plus électronégatif). Il noté +I (donneur) ou –I (attracteur). Il est additif et diminue avec la distance.
- Effets mésomères : déplacement des électrons π et n. Il est noté +M (donneur) ou –M (attracteur). Plus un composé a de formes mésomères, plus il est stable.
Les effets électroniques des groupes ont des forces différentes.
Quand les deux effets coexistent et s’opposent, l’effet mésomère l’emporte toujours (sauf halogènes).