Une onde électromagnétique de fréquence v ou de longueur d’onde λ peut aussi être décrite par des photons qui transportent chacun un quantum d’énergie E :
E=h×v=h×cλ
Avec E en Joule (J), h constante de Planck (en J.s).
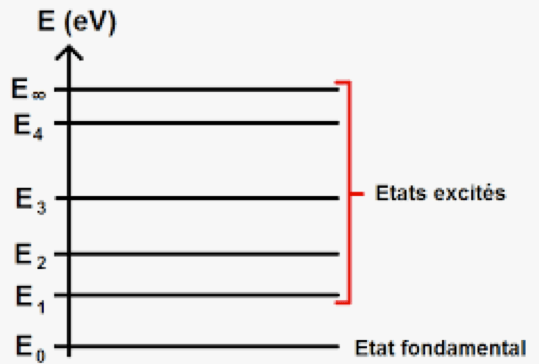
Les niveaux d'énergie d'un atome sont quantifiés et ne prennent que certaines valeurs.
L’état de plus haute énergie correspond à l’état ionisé E∞=0 eV. Les énergies des autres niveaux sont négatives.
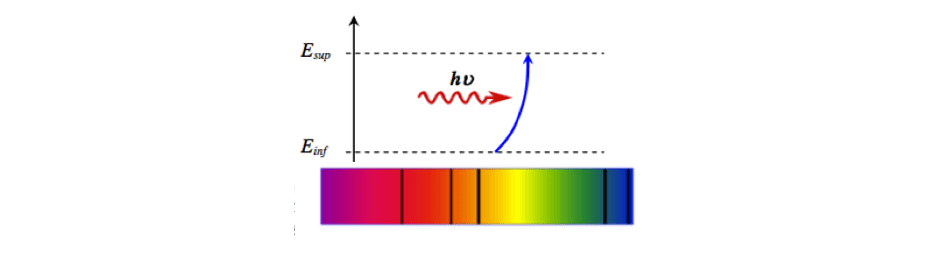
Absorption de la lumière par un atome :
Un atome qui se retrouve dans un état caractérisé par un niveau d'énergie Einf peut absorber certains photons d'énergie E bien précise et passer dans un état d'énergie Esup supérieure.
L'énergie E de ce photon correspond à l'énergie gagné par l'atome.
E=Esup−Einf
Ainsi, la longueur d'onde du photon absorbé est :
E=hcλ⇔λ=hcE=hcEsup−Einf
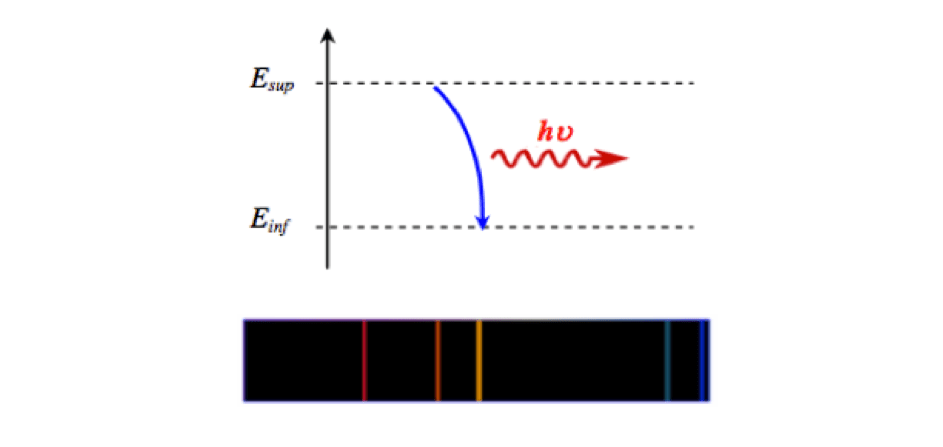
Emission de la lumière par un atome :
Un atome qui se retrouve dans un état excité (par échange électrique, absorption de lumière, chauffage…) caractérisé par un niveau d'énergie Einf en émettant un photon.
L'énergie E de ce photon correspond à l'énergie perdue par l'atome.
E=Esup−Einf
Ainsi, la longueur d'onde du photon émis sera :
E=hcλ⇔λ=hcE=hcEsup−Einf
Comme tous les atomes possèdent des niveaux d'énergie bien définis, ils ne peuvent émettre que certains photons de longueur d'onde bien précise correspond à une transition énergétique possible de l'atome. Ceci conduit, dans le domaine visible, à l'observation des raies de couleurs dans le spectre de raies d'émission.