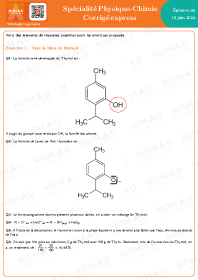
Dosage spectrophotométrique
Loi de Beer-Lambert

On écrit souvent A=k×c (relation de proportionnalité entre l'absorbance et la concentration d'une solution) donc A=f(c) donne une droite passant par l'origine.
Principe du dosage par étalonnage
Un dosage par étalonnage permet de déterminer la concentration en espèce chimique dans une solution en comparant son absorbance à celles de solutions étalons contenant la même espèce chimique et étant obtenues à partir de la dilution d'une solution mère de concentration connue. On mesure A de la gamme étalon obtenue puis on trace A=f(c). On mesure l'absorbance de la solution à doser, grâce à la courbe d'étalonnage, on lit la concentration de l'espèce chimique.

Dosage conductimétrique
Loi de Kohlrausch
La loi de Kohlrausch précise que la conductivité d'une solution peut se calculer ainsi :
σ=∑iλXi[Xi] avec σ la conductivité en S.m−1 (Siemens par mètre), λXi la conductivité molaire ionique des ions Xi en S.m2.mol−1 et [Xi] la concentration en quantité de matière en mol.m−3.
En traçant σ=f(c) on obtient donc une droite linéaire.
Méthode de dosage
On mesure la conductivité σ de plusieurs solutions-étalon, préparées par dilution d'une solution-mère de concentration rigoureusement connue.
On trace la courbe d'étalonnage. On mesure la conductivité σS de la solution de concentration en quantité de matière inconnue. On détermine alors, par projection, la concentration en quantité de matière de la solution S.