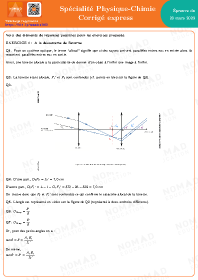
Transformation non totale
Quand le réactif limitant ne disparaît pas entièrement, la transformation n’est pas totale :
- Si xf=xmax⇒ la transformation est totale
aA(aq)+bB(aq)→cC(aq)+dD(aq) - Si xf<xmax⇒ la transformation est non totale
aA+bB ⇌ cC+dD
Le taux d’avancement final (à l’équilibre) est sans unité ⟶τ=xfxmax↖↙ en mol.
- 0<τ<1⇒ transformation non totale.
- τ=1⇒ transformation totale.
Évolution spontanée d’un système
Le quotient de réaction est une grandeur (sans unité) qui permet de connaître l’état d’avancement d’une réaction chimique. Le quotient d’une réaction aA+bB=cC+dD est définit tel que :
Qr=[C]c⋅[D]d[A]a⋅[B]b
Les concentrations [A] sont en mol.L−1 et Qr n’a pas d’unité.
Si X est un solide ou de l’eau, on remplace par [X] par 1.
Le quotient de réaction à l’état final Qrf est appelé constante d’équilibre de la réaction K.
Chaque réaction à sa propre constante d’équilibre, notée K.