L'élément chimique
L’élément chimique est l’ensemble des entités chimiques (atomes ou ions) caractérisées par le même nombre Z de protons dans leur noyau. L’élément est représenté par son symbole chimique.
Le tableau périodique
On classe les éléments chimiques dans un tableau. Le tableau périodique des éléments comporte 112 éléments chimiques connus. Il est constitué de 18 colonnes et de 7 lignes ou périodes.
On distingue deux catégories d’éléments : les métaux et les non-métaux. Les éléments sont classés par numéro atomique Z croissant.
Les éléments de la première ligne ont une couche électronique occupée (K), ceux de la seconde deux couches (K et L), ceux de la troisième 3 couches (K, L et M).
Les différents éléments chimiques
Les atomes des éléments d’une même colonne ont le même nombre d’électrons sur leur couche externe : un électron pour la colonne 1, 2 pour la colonne 2 etc.
Les éléments ayant des propriétés chimiques voisines forment une famille. Ils sont placés dans la même colonne. Leurs propriétés chimiques sont dues aux nombres d’électrons de leur couche externe.
A l’exception de l’hydrogène, les éléments de la première colonne appartiennent à la famille des alcalins.
Les éléments de la 17è colonne (7è colonne de la classification simplifiée) appartiennent à la famille des halogènes. Les gaz rares font partie de la 18è colonne. Ils sont inertes chimiquement.
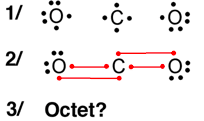
Les atomes forment des molécules pour satisfaire la règle du duet ou de l’octet. Chaque liaison apporte un électron à la dernière couche électronique de l’atome.