Changement d’état
📝 Mini-cours GRATUIT
Quantité d’énergie chimique transférée
🍀 Fiches de révision PREMIUM

Énergie chimique
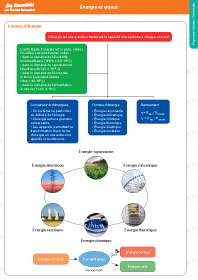
Énergie et enjeux

Les propriétés des matériaux et l'organisation de la matière

Énergie transportée par la lumière

Énergie mécanique

Les réactions acido-basiques

Les réactions d'oxydoréduction

Travail d'une force
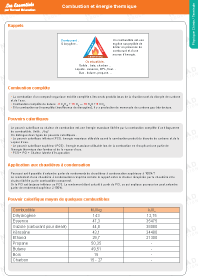
Combustion et énergie thermique



