Une onde électromagnétique de fréquence ν ou de longueur d’onde λ peut aussi être décrite par des photons qui transportent chacun un quantum d’énergie E :
E=h×ν=h×cλ
Avec E en Joule (J), h constante de Planck (en J.s).
Les niveaux d’énergie d’un atome sont quantifiés et ne prennent que certaines valeurs.

L’état de plus haute énergie correspond à l’état ionisé E∞=0eV. Les énergies des autres niveaux sont négatives.
Absorption de la lumière par un atome :
Un atome qui se retrouve dans un état caractérisé par un niveau d'énergie Einf peur absorber certains photons d'énergie E bien précise dans un état d'énergie Esup supérieure.
L'énergie E de ce photon correspond à l'énergie gagnée par l'atome :
E=Esup−Einf
Ainsi, la longueur d'onde du photon absorbé est :
E=hcλ⇔λ=hcE=hcEsup−Einf
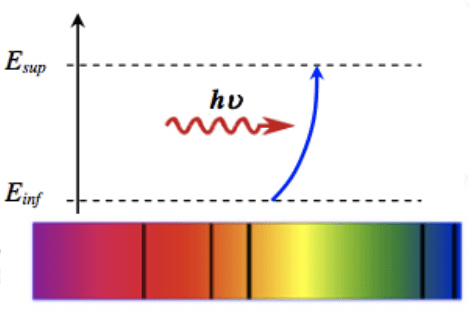
Comme tous les atomes possèdent des niveaux d'énergie bien définis, ils ne peuvent absorber que certains photons de longueur d'onde bien précise. Ceci conduit, dans le domaine du visible, à l'observation des raies noires dans le spectre de raies d'absorption.
Emission de la lumière par un atome :
Un atome qui se retrouve dans un état excité (par décharge électrique, absorption de lumière, chauffage…) caractérisé par un niveau d'énergie Esup retourne spontanément dans son état fondamental ou dans un état excité de moindre énergie Einf en émettant un photon.
L'énergie E de ce photon correspond à l'énergie perdue par l'atome.
E=Esup−Einf
Ainsi, la longueur d'onde du photon émis sera :
E=hcλ⇔λ=hcE=hcEsup−Einf
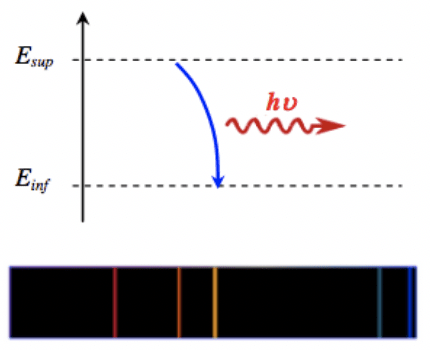
Comme tous les atomes possèdent des niveaux d'énergie bien définis, ils ne peuvent émettre que certains photons de longueur d'onde bien précise correspondent à une transition énergétique possible de l'atome. Ceci conduit, dans le domaine du visible, à l'observation des raies de couleurs dans le spectre de raies d'émission.



