Les enzymes sont des biocatalyseurs. Ces derniers présentent plusieurs caractéristiques :
- Diminuent l’énergie d’activation.
- Ont une double spécificité : de substrat et de réaction
- Sont classées : oxydo-réductases, transférases, hydrolases, lyases, isomérases, ligases. La commission internationale des enzymes leur attribue un code EC. Depuis 2018, une septième classe d’enzymes est apparue : les translocases
- Sont régénérées à la fin de la réaction
- De nature protéique.
- Certaines sont régulées à l’aide d’inhibiteurs ou d’activateurs
Les enzymes sont des protéines et peuvent être dénaturées par la chaleur, le pH, les solvants, les ions.
Une enzyme (holoenzyme) est composée d’une partie non protéique (coenzyme) et d’une partie protéique (apoenzyme). Cette dernière est divisée en un site de fixation et un site catalytique. L’ensemble est appelé « site actif ».
Une réaction enzymatique est caractérisée par la réaction suivante :
(E : Enzyme, P : Produit et S : Substrat)
![]()
Les enzymes sont caractérisées par deux paramètres cinétiques :
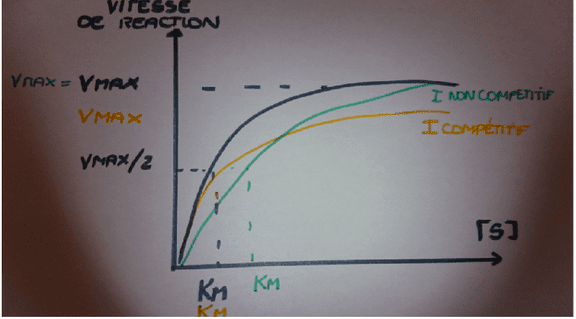
• KM : constante de Michaelis-Menten qui est définie comme la concentration en substrat pour laquelle Vmax est divisée par 2. Elle reflète l’inverse de l’affinité de l’enzyme pour son substrat. Elle est exprimée en mol/L de milieu réactionnel.
• Vmax (vitesse maximale) ou z qui correspond à la catabilité de l’enzyme c’est-à-dire la quantité de substrat transformé (en mole) par unité de temps (en seconde) dans un système d’essai défini (température optimale, pH optimal de l’enzyme). Son unité est le Katal.
L’activité des enzymes est maximale pour des conditions données : de pH, de température, de force ionique. Les deux paramètres peuvent être influencés par des inhibiteurs ou des activateurs. Les inhibiteurs peuvent être compétitifs (modification de KM), non compétitifs (modification de Vmax) ou incompétitifs (modification de KM et Vmax).
Effets des inhibiteurs compétitifs (KM augmente) et non compétitifs (Vmax diminue)