La présence simultanée de l’espèce AH et de l’espèce A− en solution aqueuse empêche le pH de varier sensiblement lors d’un ajout modéré d’acide fort ou de base forte, ou encore lors d’une dilution.
Une telle solution est appelée solution tampon.
En d’autres termes, si le pH d’une solution est tel que l’espèce AH et l’espèce A− ont des concentrations non négligeables l’une par rapport à l’autre, on a une solution tampon.
Solution tampon :
Une solution tampon renferme un acide faible et sa base conjuguée en concentrations égales ou voisines.
On sait que pH=pKA+log[Base][Acide]
Si [Base]=[Acide] alors pH=pKA.
Si [Base] est voisin de [Acide] alors pH est voisin de pKA.
Une solution tampon possède un pH égal ou voisin du pKA du couple ayant servi à la préparer.
Le pH d'une solution tampon évolue peu :
- Par addition en quantité modérée d'acide
- Par addition en quantité modérée de base
- Par dilution limitée.
Effet tampon :
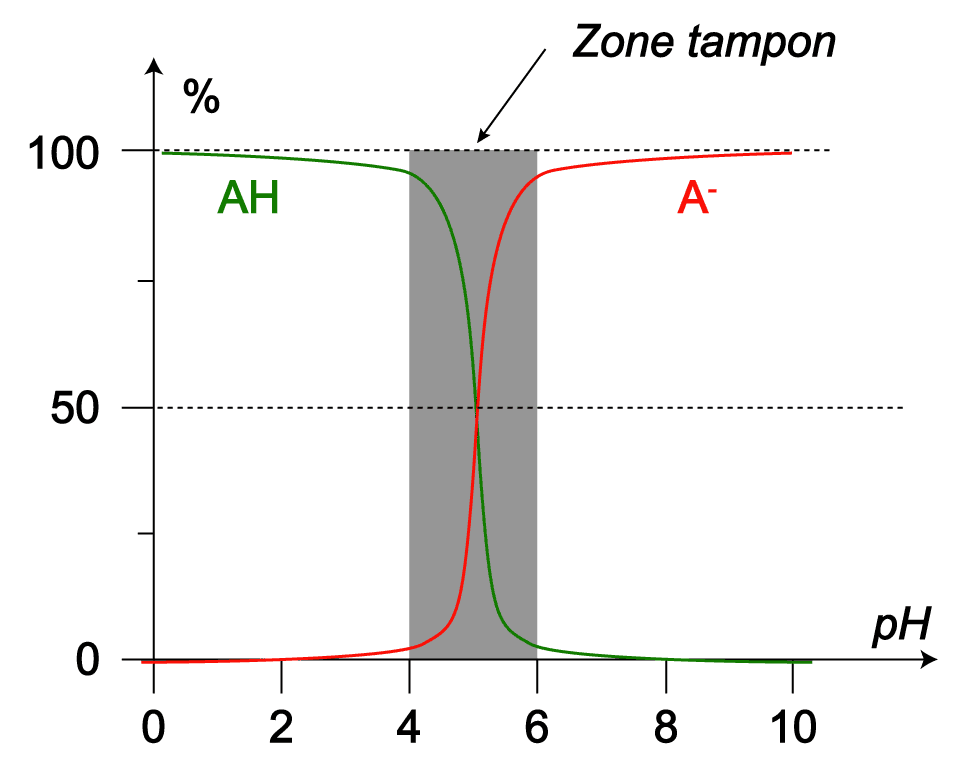
Exemple :
On considère AH/A− dont le pKA vaut 5,0.
Si le pH de la solution aqueuse contenant ces espèces est compris entre 4,0(pKA−1) et 6,0(pKA+1), alors la solutione est tampon.
Si le pH de la solution est supérieur à 6,0 ou inférieur à 4,0, une des deux espèces devient négligeable par rapport à l'autre et la solution n'est plus tampon.
La présence simultanée de l'espèce AH et de l'espèce A− en solution aqueuse empêche le pH de varier sensiblement lors d'un ajout modéré d'acide fort ou de base forte, ou encore lors d'une dilution.
Une telle solution est appelée solution tampon.
En d'autres termes, si le pH d'une solution est tel que l'espèce AH et l'espèce A− ont des concentrations non négligeables l'une par rapport à l'autre, on a une solution tampon.