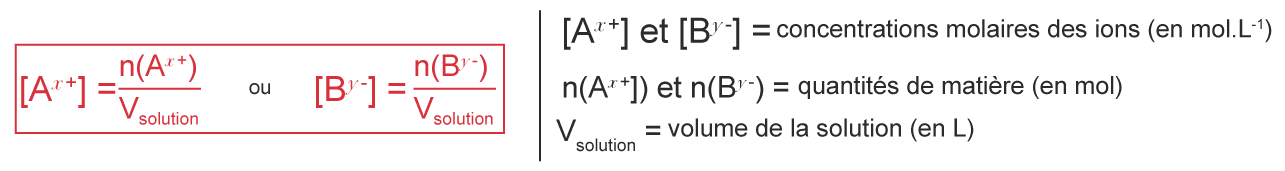Un solide ionique est constitué de cations et d’anions régulièrement disposés dans l’espace. Il est électriquement neutre. La cohésion d’un solide ionique est assurée par les interactions électrostatiques attractives entre les charges opposées, donc entre les cations (ions positifs) et les anions (ions négatifs).
Un solvant polaire, comme l’eau, est constitué de molécules polaires.
Un solvant apolaire, comme le cyclohexane, est constitué de molécules apolaires.
Les solides ioniques sont solubles dans les solvants polaires, ils sont solubles dans l’eau par établissement d’interactions électrostatiques attractives entre les charges des ions du soluté et les charges partielles des molécules d’eau.
Les solutés moléculaires polaires sont solubles dans les solvants polaires.
L’équation de dissolution d’un solide ionique AnBm(s) dans l’eau s’écrit :
AyBx(s)→yAx+(aq)+xBy−(aq)
La concentration en quantité de matière des ions Ax+ et By− est :