Une onde électromagnétique est caractérisée par sa fréquence v(en Hz) ou par sa longueur d’onde λ (en m). Elle transporte de l’énergie mais pas de matière. Elle peut se propager dans le vide. La lumière peut être décrite par une onde électromagnétique d’où le modèle ondulatoire.
λ=cv avec λ en m, c vitesse de propagation de la lumière dans le vide en m.s−1 et en .
Le domaine de la lumière visible s’étend de à .

Une onde électromagnétique de fréquence υ ou de longueur d’onde λ peut aussi être décrite par des photons qui transportent chacun un quantum d’énergie :
avec en Joule , constante de Planck (en ).
Les niveaux d’énergie d’un atome sont quantifiés et ne prennent que certaines valeurs.

L’état de plus haute énergie correspond à l’état ionisé . Les énergies des autres niveaux sont négatives.
Absorption de la lumière par un atome
Un atome qui se retrouve dans un état caractérisé par un niveau d'énergie peur absorber certains photons d'énergie bien précise dans un état d'énergie supérieure.
L'énergie de ce photon correspond à l'énergie gagnée par l'atome :
Ainsi, la longueur d'onde du photon absorbé est :
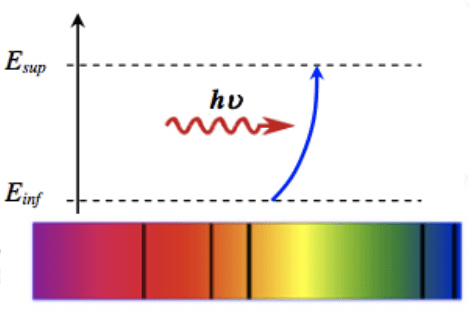
Comme tous les atomes possèdent des niveaux d'énergie bien définis, ils ne peuvent absorber que certains photons de longueur d'onde bien précise. Ceci conduit, dans le domaine du visible, à l'observation des raies noires dans le spectre de raies d'absorption.
Emission de la lumière par un atome :
Un atome qui se retrouve dans un état excité (par décharge électrique, absorption de lumière, chauffage,…) caractérisé par un niveau d'énergie retourne spontanément dans son état fondamentale ou dans un état excité de moindre énergie en émettant un photon.
L'énergie de ce photon correspond à l'énergie perdue par l'atome.
Ainsi, la longueur d'onde du photon émis sera :
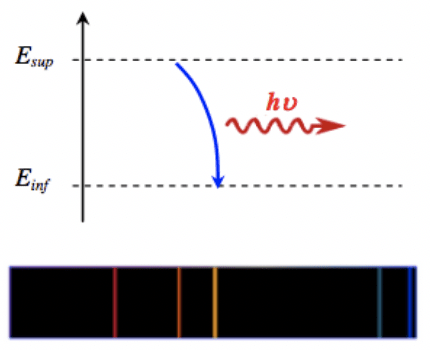
Comme tous les atomes possèdent des niveaux d'énergie bien définis, ils ne peuvent émettre que certains photons de longueur d'onde bien précise correspondent à une transition énergétique possible de l'atome. Ceci conduit, dans le domaine du visible, à l'observation des raies de couleurs dans le spectre de raies d'émission.



